Презентація«Молярний об’єм» 8 клас
Про матеріал
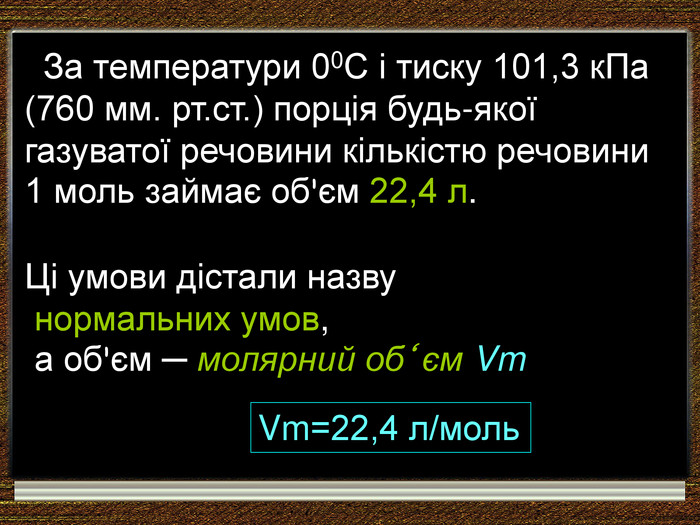
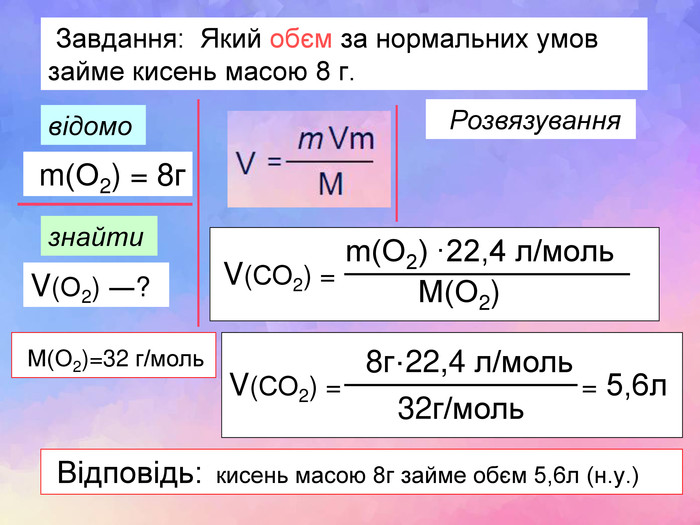
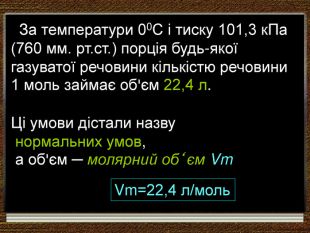
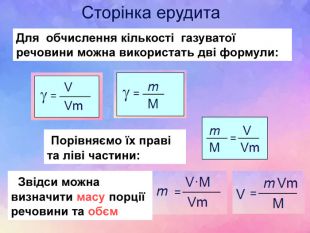
| Презентація допоможе в проведенні уроку на тему: «Закон Авогадро. Молярний об'єм газів». Розв'язування розрахункових задач №8 «Обчислення об'єму певної маси або кількості речовини відомого газу за нормальних умов.» |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
































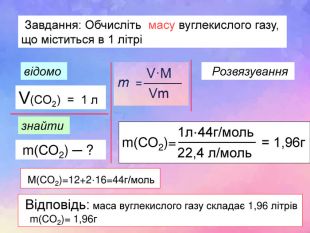

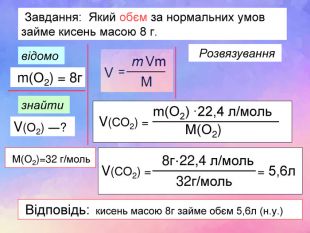


-

Остаповець Юрій
11.01.2024 в 17:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Авєркіна Світлана Анатоліївна
07.12.2022 в 12:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
21.01.2021 в 10:58
Красно дякую за чудову розробку!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тихончук Олександр Васильович
10.01.2021 в 21:32
Чудова робота. Чітко, лаконічно, ефектно.Велике спасибі.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Палій Людмила Олександрівна
08.01.2021 в 20:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kiriyenko Olena
04.01.2021 в 19:25
Дякую! Яскраво, зрозуміло!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Киливник Наталия
01.02.2019 в 20:01
Якісно, коротко,оригінально
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бицина Оксана Валеріївна
18.09.2018 в 16:45
Цікава подача матеріалу
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків