Конспект уроку з хімії для 8 класу за темою: "Кристалічні ґратки. Атомні, молекулярні та йонні кристали"
Урок з хімії для 8-го класу за темою:"Кристалічні ґратки. Атомні, молекулярні та йонні кристали." проводиться за методом перегорнутого класу.
Для оптимізації уроку та підвищення пізнавального інтересу учнів використовуються хмарні технології (платформа Google та Office 365), ІКТ (електронна пошта Outlook, Інтернет, ППЗ «Хімія. 9 клас», сайт znanius.com) та різноманітні форми навчання : індивідуальні (розв'язання розрахункових задач, створення таблиці, робота із підручником), групові (створення схеми, робота із підручником, лабораторний дослід), фронтальне опитування, робота біля дошки, евристична бесіда, самостійна робота. Встановлюються міжпредметні зв'язки з інформатикою, фізикою, мистецтвом.
Клас: 8-А Вчитель: Гавриліна В.В.
Урок
Тема: Кристалічні ґратки. Атомні, молекулярні та йонні кристали.
Мета:
- сформувати в учнів поняття про кристалічні ґратки;
- ознайомити з кристалічним та аморфним станами речовин, з типами кристалічних ґраток (атомним, молекулярним, йонним);
- розглянути вплив хімічного зв’язку на тип кристалічних ґраток;
- на прикладах продемонструвати зв’язок між типом кристалічних ґраток й фізичними властивостями речовини;
- продовжувати формувати навички виконання лабораторних дослідів, виконання техніки безпеки при роботі із хімічними реактивами, лабораторним посудом та обладнанням.
Очікувані результати: учні мають уміти визначати особливості будови аморфних та кристалічних речовин; виявляти залежність між будовою кристалічних речовин та їхніми фізичними властивостями; визначати тип кристалічних ґраток речовини за їх фізичними властивостями.
Базові поняття й терміни: кристалічні ґратки, йонні кристалічні ґратки, атомні кристалічні ґратки, молекулярні кристалічні ґратки, металічні кристалічні ґратки, хімічний зв’язок, електронегативність.
Обладнання: інтерактивна дошка, мультимедійний проектор, ноутбук, мобільні телефони учнів, колби, спиртівка, ложки для спалювання, сірники, ступка з товкачем, штатив з пробірками.
Реактиви: вода, кухонна сіль, цукор, пісок.
Методи навчання: метод перегорнутого класу, проблемне навчання, дослідницький метод, ілюстративно-наочний, дистанційне навчання, пояснювально-евристичний, аналітичний, контролюючо-корегуючий.
Форми навчання: індивідуальні (розв’язання розрахункових задач, створення таблиці, робота із підручником), групові (створення схеми, робота із підручником, лабораторний дослід), фронтальне опитування, робота біля дошки, евристична бесіда.
Технології: хмарні (платформа Google та Office 365), ІКТ (електронна пошта Outlook, Інтернет, ППЗ «Хімія. 9 клас», сайт znanius.com).
Тип уроку: комбінований.
Структура уроку.
- 1. Організаційний етап
- 2. Актуалізація опорних знань і мотивація навчальної діяльності
2.1. Тестування Forms на платформі Office 365 (використання мобільних телефонів та мережі Інтернет). Із самоперевіркою. Аналіз результатів тестування на екрані інтерактивної дошки (діаграми сводних результатів класу)
2.2. Бесіда.
1. Із яких частинок виготовлені екрани ваших мобільних телефонів, планшетів, ноутбуків та сучасних телевізорів? (На екрані інтерактивної дошки картинки демонструються із зображенням мобільного телефона та карамельок на паличці).
2. Як виготовити карамельку, яка зображена на екрані?
2.3. Показ практичного значення вивчення нового матеріалу.
Слово вчителя
Розгляньте речовини, які лежать на ваших столах. Чим вони відрізняються між собою? Як ви вважаєте, що це за речовини? Правильно, це знайомі вам цукор, кухонна сіль, пісок та крохмаль. Сьогодні на уроці ми будемо досліджувати властивості цих речовин. Але вивчення матеріалу буде відбуватися за методом перегорнутого класу. Ви вже отримали домашнє завдання розібрати параграф 22 підручника, ви опрацювали параграфи електронного підручника «Хімія. 9 клас» та попрацювали із дистанційним уроком на платформі klasna.ocinka за посиланням http://klasnaocinka.com.ua/ru/dl/course/view/course_id/14857. Тому на уроці ми більш активно засвоїмо тему.
2.4. Повідомлення теми і мети уроку.
- 3. Етап засвоєння нових знань
План пояснення нового матеріалу. Евристична бесіда. На екрані інтерактивної дошки відкриваються сторінки дистанційного уроку на платформі klasna.ocinka
- Поняття про кристалічні й аморфні тіла.
Демонстрація. Аморфні (скло, смола) і кристалічні (графіт, кухонна сіль) речовини.
На екрані картинки виробів із скла, мозаїки із скла, фото майстра, який в Діснейленді в Парижі виготовляє фігурки із скла на очах дітей.
Що таке кристал? Ви повинні були виписати правило в зошит. Знайдіть формулювання цього поняття в підручнику.
- Поняття про кристалічні ґратки. (Евристична бесіда, супроводжувана демонстрацією.)
Демонстрація. Моделі кристалічних ґраток різних типів. (Стоять на демонстраційному столі)
Що називають кристалічними ґратками? (робота із підручником)
- Типи кристалічних ґраток. (Евристична бесіда, заповнення схеми, яка лежить на столах перед кожним учнем.) Які частинки лежать в вузлах кристалічних ґраток? Які речовини мають певний тип ґратки? Від чого це залежить? Правильно, від типу хімічного зв’язку.
- Робота в групах по 4 учні: Об’єднатися в групи та виписати із параграфа, конспекту чи Інтернету в мобільному телефоні фізичні властивості кожного типу ґраток.
- В цей час на дошці 2 учні розв’язують розрахункові задачі на визначення невідомого елемента.
- Вищий оксид хімічного елемента V групи головної підгрупи має відносну молекулярну масу 108. Назвіть елемент, складіть його електронну та графічну формулу. (Відповідь: Нітроген)
- Елемент IV групи головної підгрупи утворює вищий оксид, масова частка Оксигену в якому 30,48%. Назвіть елемент. Складіть формулу його оксиду.
( Відповідь: Станум)
- По завершенню роботи учні біля дошки пояснюють задачі, а потім відбувається аналіз результатів роботи в групах. Учні називають властивості кожної ґратки, які вони виписали, а потім вчитель відкриває на екрані слайди із правильними повними відповідями на платформі klasna.ocinka.
Робота із підручником по малюнкам кристалічних ґраток (с. 121-122).
- Опрацюйте таблицю порівняння властивостей і будови алмазу і графіту, яка лежить у вас на столах. (На екрані картинка алмазу і графіту із програми «Хімія. 9 клас» урок № 25). Який хімічний елемент утворює алмаз та графіт? Чому один і той же Карбон утворює такі різні прості речовини? Від чого це залежить? Правильно, від будови речовин. Таким чином, ми бачимо, що не тільки склад впливає на властивості речовин, а й будова. Знаючи будову, можна спрогнозувати властивості і навпаки. Ознайомтеся із трикутником пізнання в хімії:
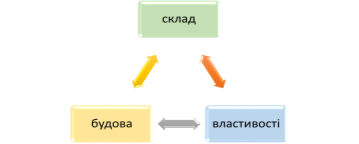
- 4. Узагальнення й систематизація знань.
Інструктаж з БЖД (в зошитах для лабораторних робіт)
Виконання лабораторного досліду. Дослідження кухонної солі, цукру і піску на розчинність у воді, твердість та здатності розплавлятися при нагріванні.
- 5. Контроль навчальних досягнень.
- Тестування в ППЗ «Хімія. 9 клас» фронтальне.
- Тестування Forms на платформі Office 365 індивідуальне (використання мобільних телефонів та мережі Інтернет). Із самоперевіркою.
- 6. Домашнє завдання, інструктаж щодо його виконання
6.1. Завдання для всього класу.
- Підручник Ярошенко §22, вивчити. §21 прочитати, скласти конспект.
- Виконати за бажанням домашній дослід на виготовлення карамельки або вирощування кристалів (с. 123 підручника), зняти відео або фото на гаджет, надіслати на office 365 або показати на перерві.
- ППЗ «Хімія. 9 клас». Переглянути урок 25.
Індивідуальне завдання.
- Підготуйте за бажанням повідомлення про фізичні властивості карборунду, сірки та йоду.
- Зайти за посиланням на віртуальну інтерактивну дошку https://padlet.com/v1kgavr72/69b3kkcmnc09
та записати свої враження від уроку:
- Що Вам сподобалося на уроці?
- Які питання виявилися складними?
- Які форми роботи найефективніші?
- 7. Підбиття підсумків уроку
Учитель разом з учнями підбиває підсумки уроку. Оцінка буде складатися із балів, які ви набрали за урок: по 4 бали за два тестування (при всіх правильних відповідях), 3 бали за лабораторний дослід та 1 бал за активність на уроці.
- 8. Рефлексія.
Учні через мобільні телефони заходять за посиланням на віртуальну інтерактивну дошку https://padlet.com/v1kgavr72/69b3kkcmnc09
та записують свої враження від уроку:
- Що Вам сподобалося на уроці?
- Які питання виявилися складними?
- Які форми роботи найефективніші?
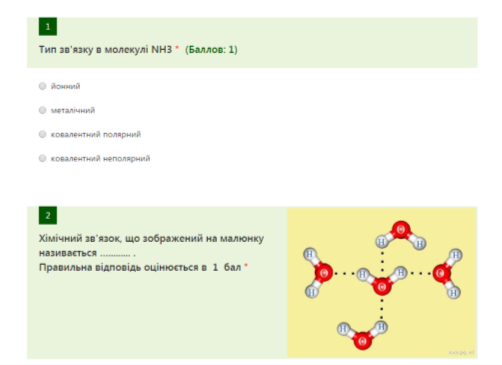
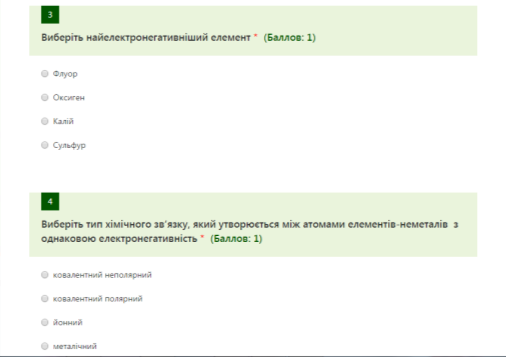
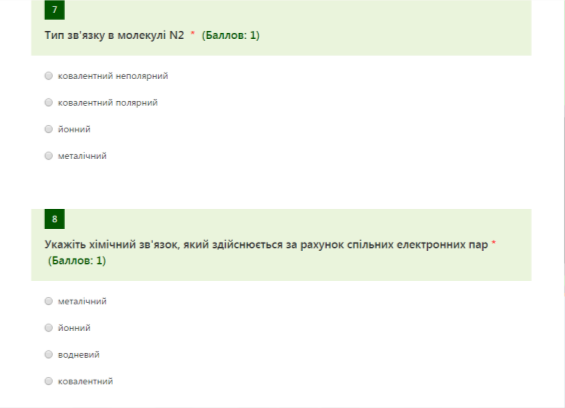
Тест на перевірку домашнього завдання:



про публікацію авторської розробки
Додати розробку
