Презентація на тему: "Йони. Йонний зв'язок, його утворення"
Про матеріал
Презентація з хімії для учнів 8 класу на тему "Йони. Йонний зв'язок, його утворення" розкриває принцип утворення йонного зв'язку. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




![Утворення йонного зв’язку11 Na 1s22s22p63s1 - 1e → Na +1 1s22s22p6 [10 Ne] 17 Cl 1s22s22p63s2 3p5 +1e →Cl -11s22s22p63s2 3p6 [18 Ar] Na - 1e → Na +1 Cl + 1e → Cl -1 Утворення йонного зв’язку11 Na 1s22s22p63s1 - 1e → Na +1 1s22s22p6 [10 Ne] 17 Cl 1s22s22p63s2 3p5 +1e →Cl -11s22s22p63s2 3p6 [18 Ar] Na - 1e → Na +1 Cl + 1e → Cl -1](/uploads/files/1146538/228410/244388_images/4.jpg)
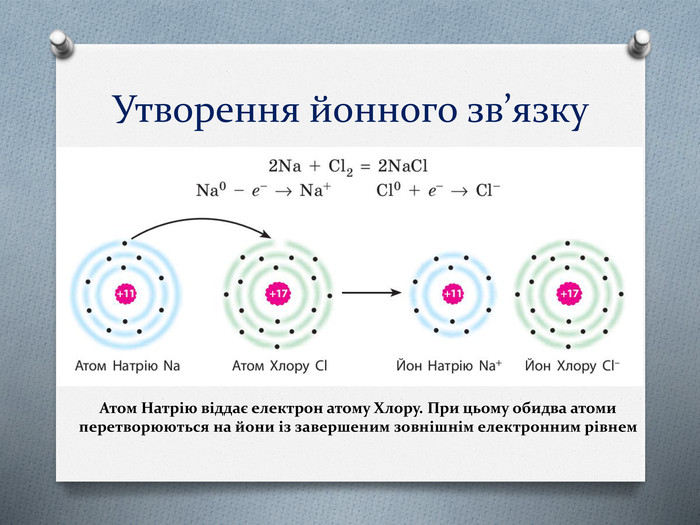
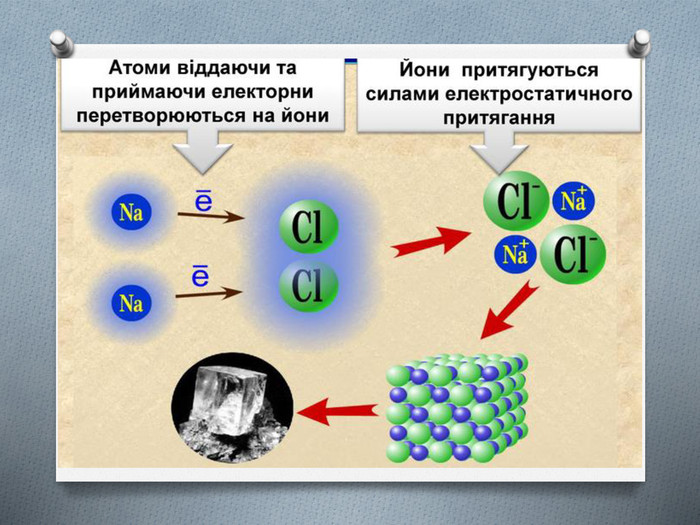


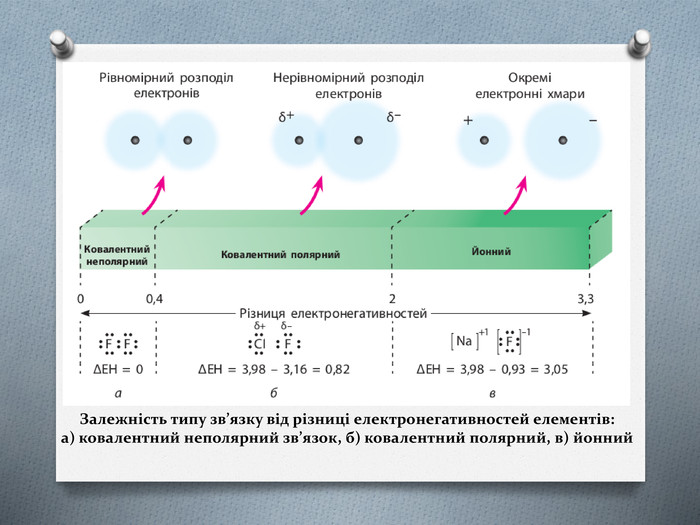






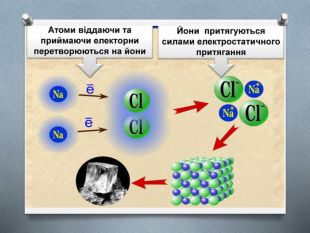


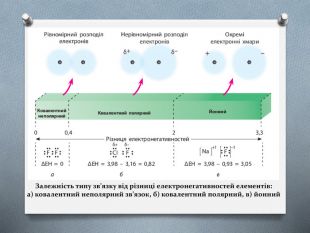


-

Гурська Оксана Вікторівна
14.11.2024 в 08:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Головатюк Лілія Євгеніївна
28.11.2023 в 12:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
23.11.2023 в 07:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Полуда Тетяна Олександрівна
05.11.2023 в 18:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Смакоуз Тамара Василівна
28.11.2022 в 20:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
13.11.2022 в 18:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Носова Антоніна Анатоліївна
12.11.2022 в 08:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Нікітенко Наталія Володимирівна
24.11.2021 в 18:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
14.11.2021 в 19:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків