Презентація "Натрій гідроксид"
Про матеріал
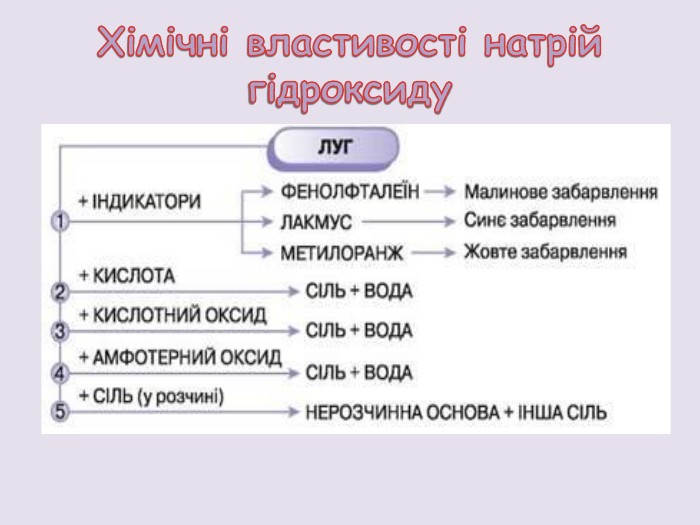
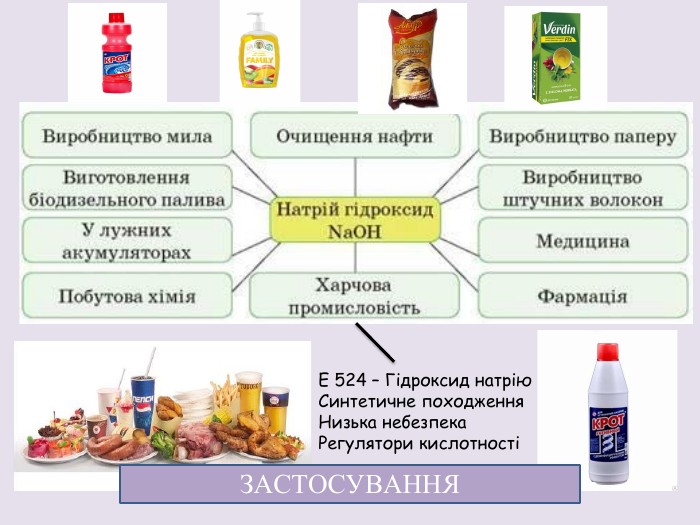
Презентація розкриває фізичні та хімічні властивості натрій гідроксиду.; основні способи добування та застосування, а також попереджає про правила техніки безпеки під час роботи з їдкою основою. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку