Презентація " Солі "
Про матеріал
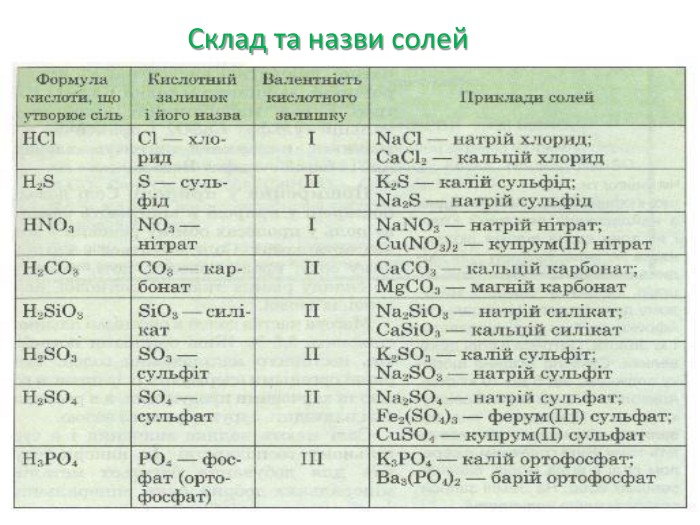
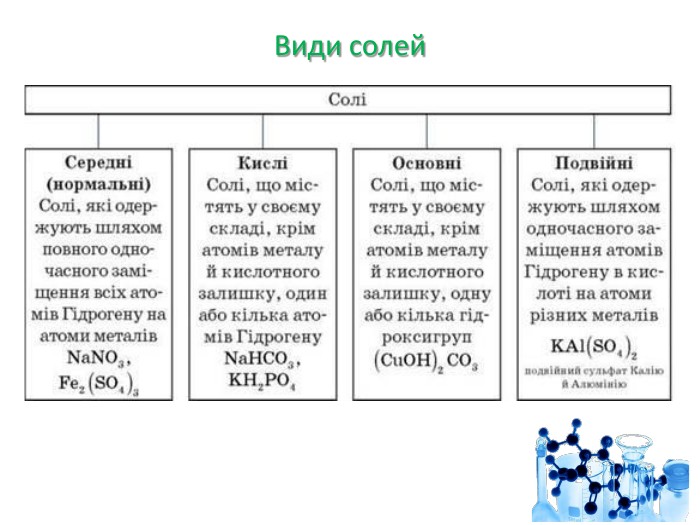
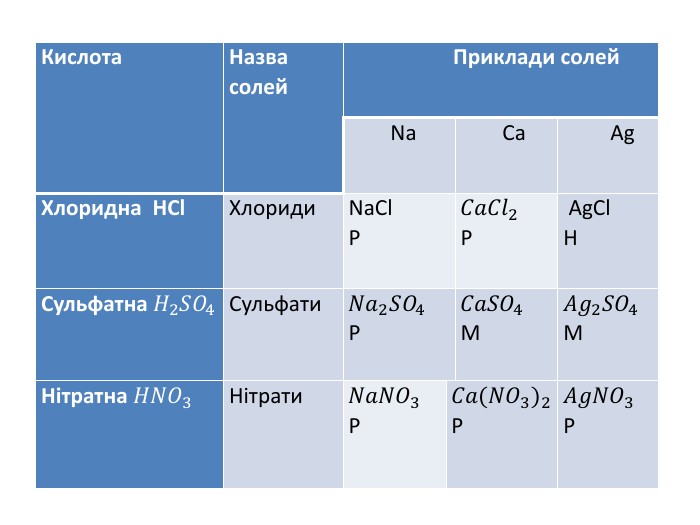
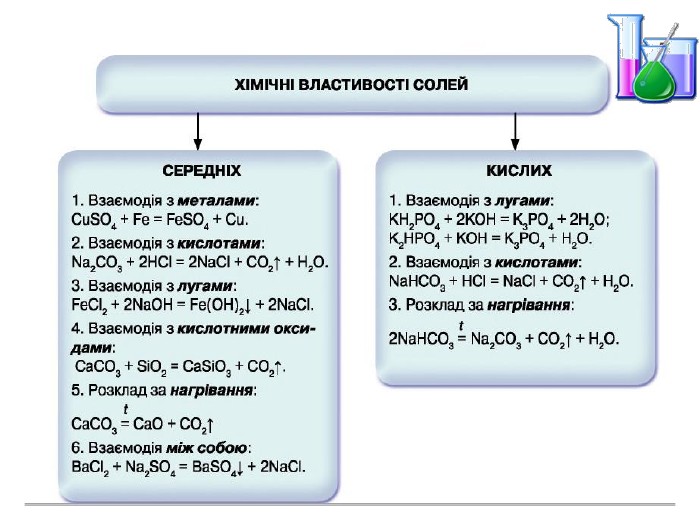
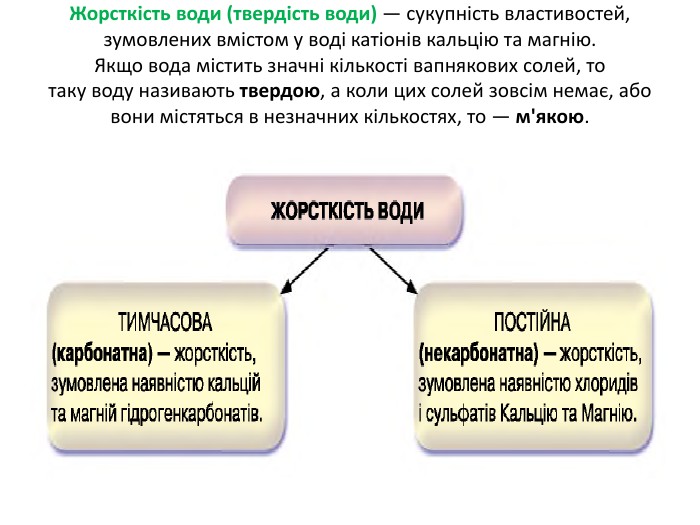
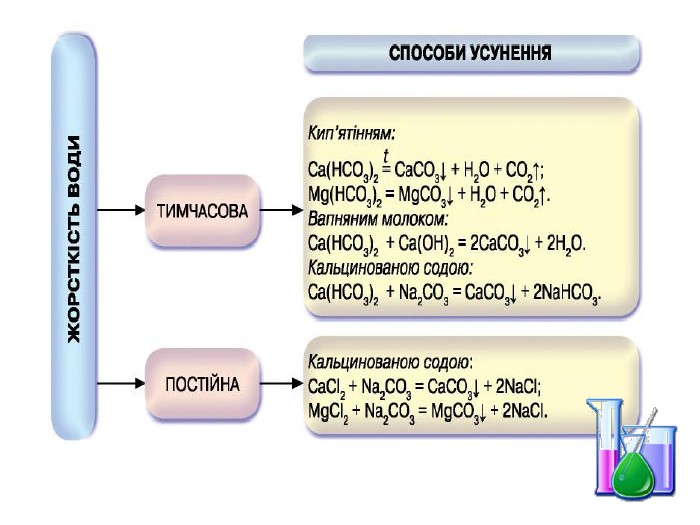
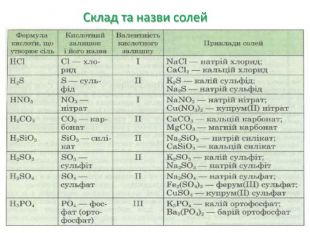
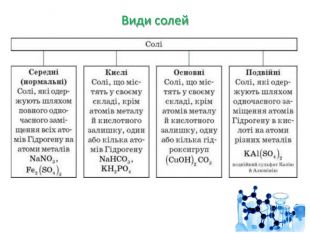
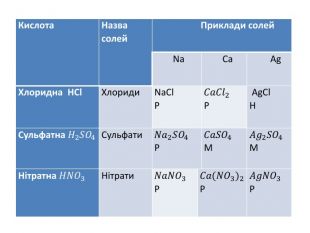
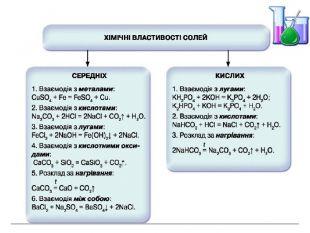
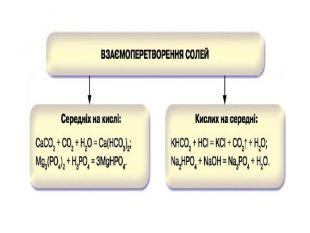
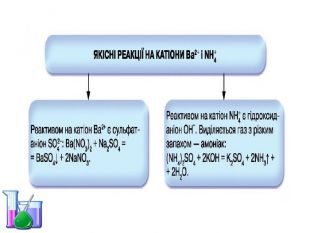
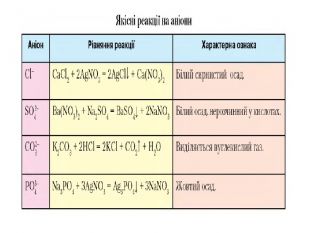
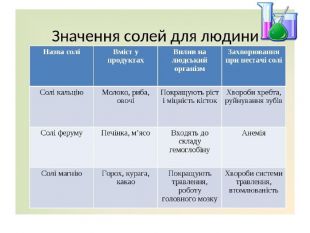
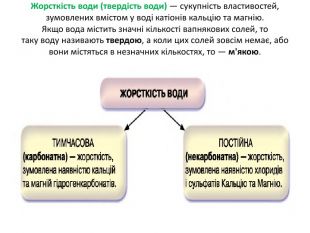
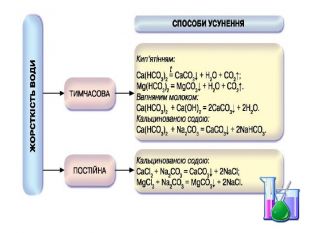
Презентація "Солі, їх поширення в природі. Середні та кислі солі" для 11 класу. Мета: узагальнити і відкорегувати знання учнів про солі, їх поширення в природі, детально зупинитися на класифікації солей та їхніх хімічних властивостях; удосконалювати вміння щодо складання рівнянь хімічних реакцій за участі солей. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку