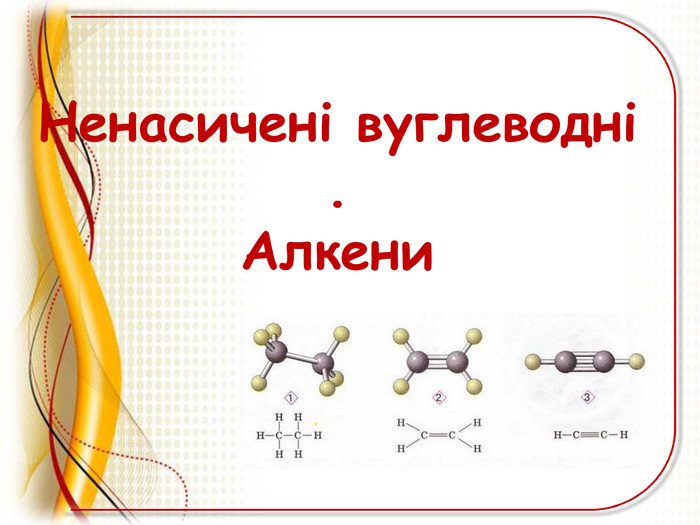
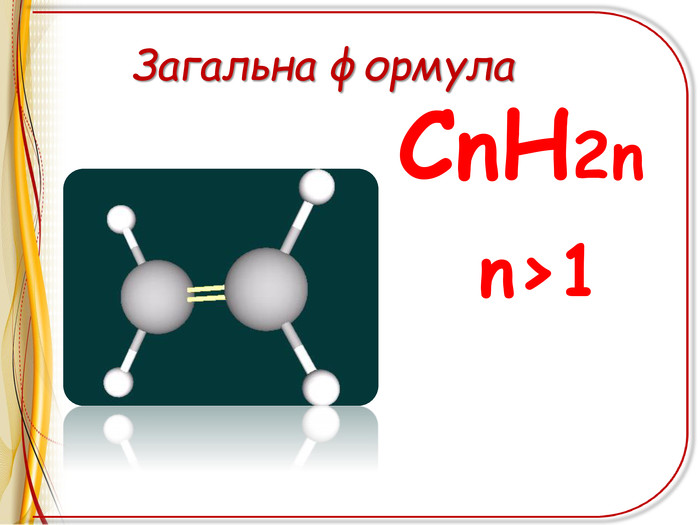
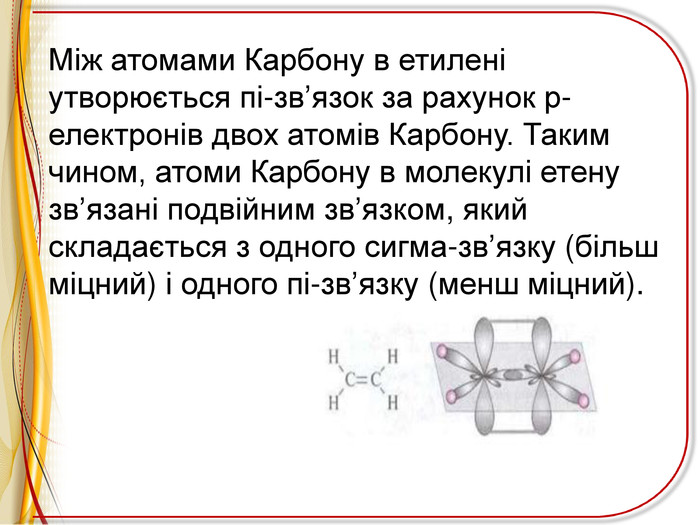
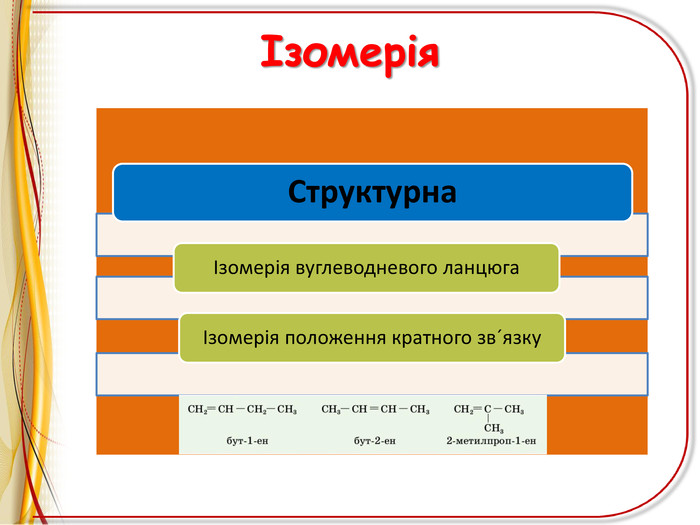
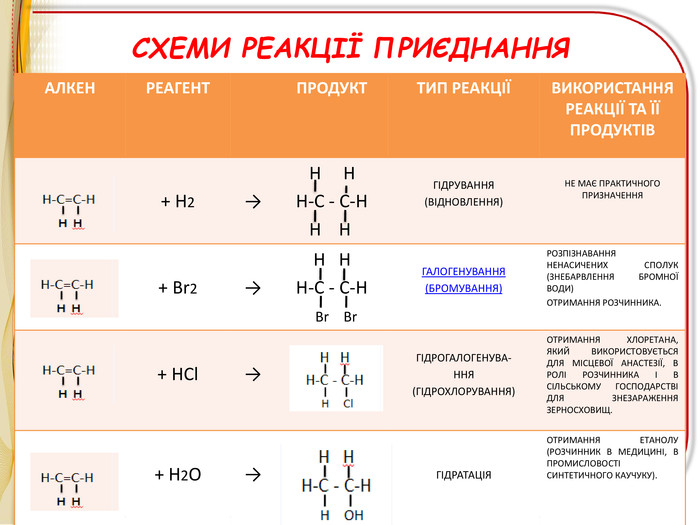
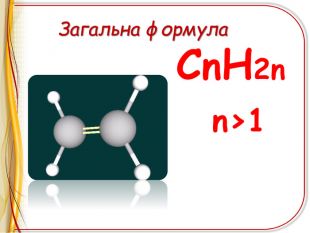
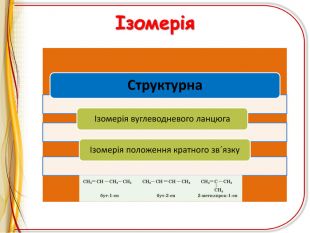
Презентація"Ненасичені вуглеводні .Алкени"
Про матеріал
Матеріали до уроку при вивченні теми:"Вуглеводні".
Презентація"Ненасичені вуглеводні .Алкени" Перегляд файлу
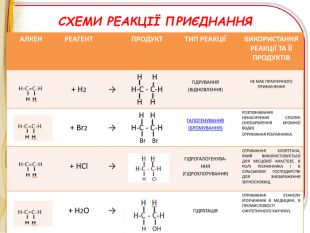
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку