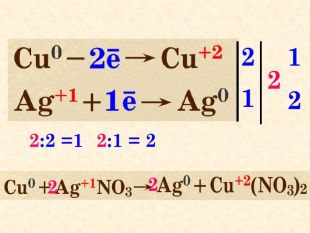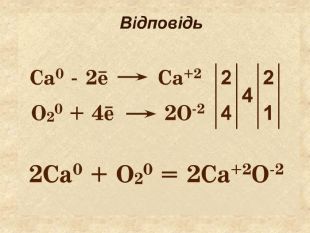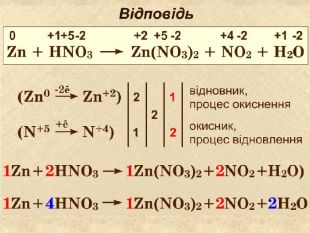Презентація "Окисно-відновні реакції"









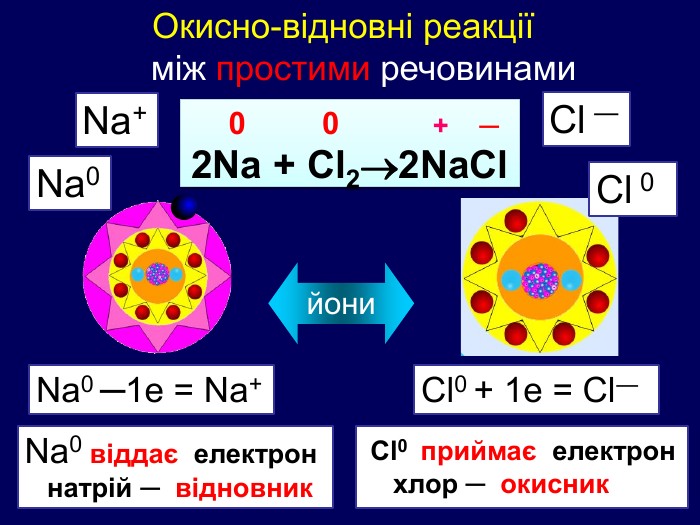
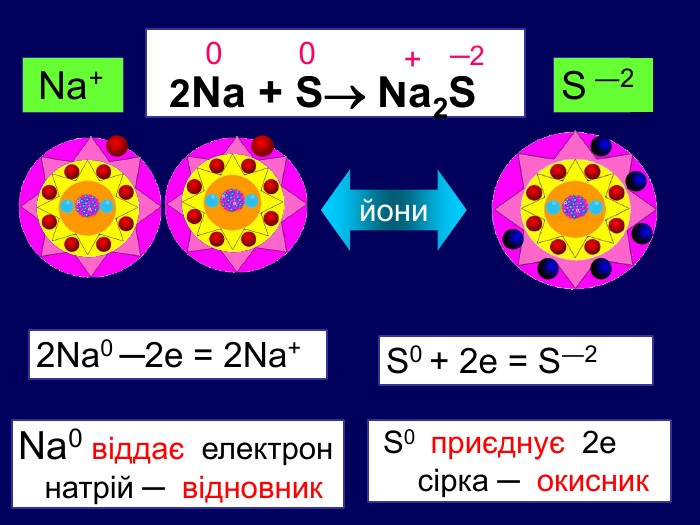






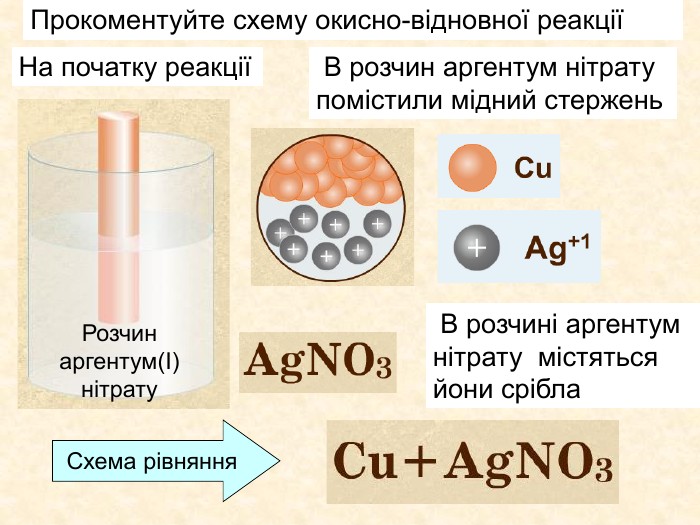
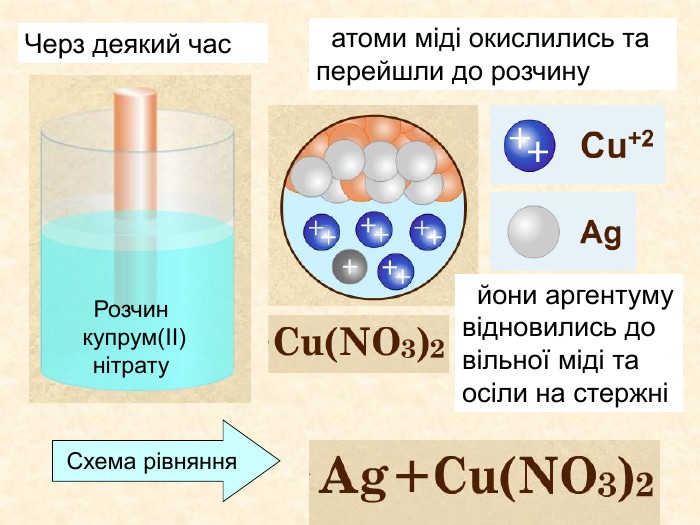
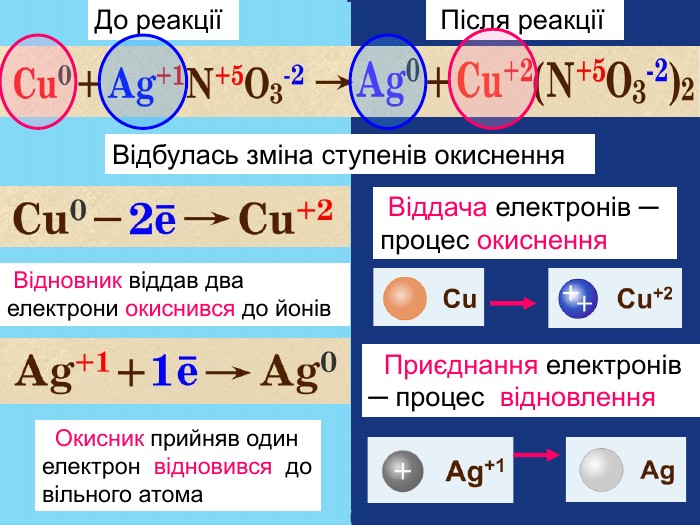
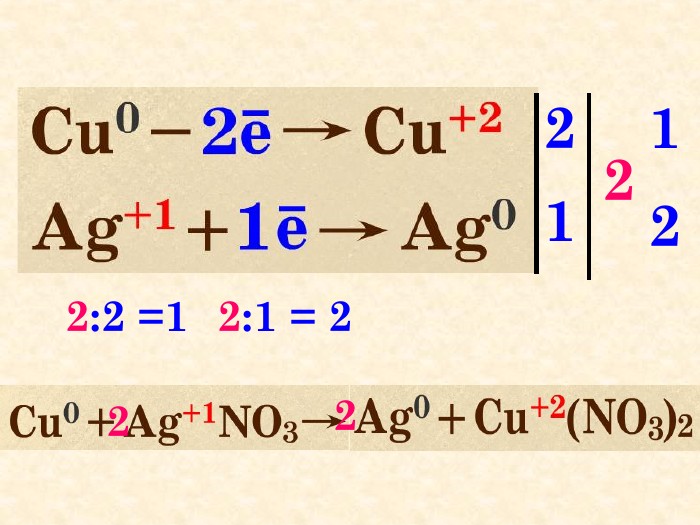

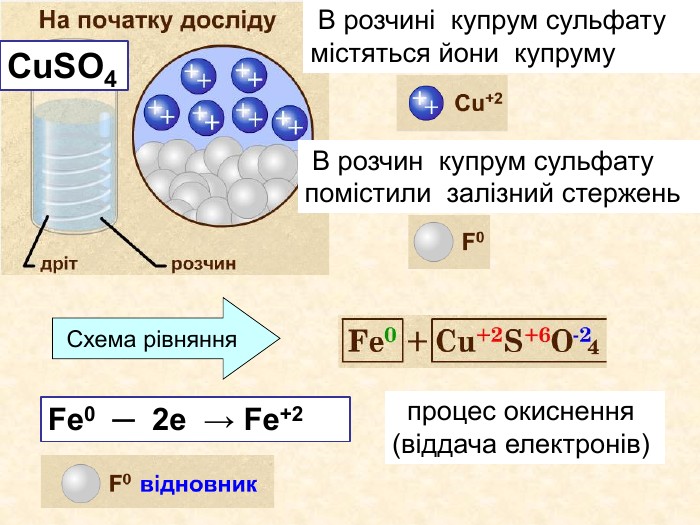
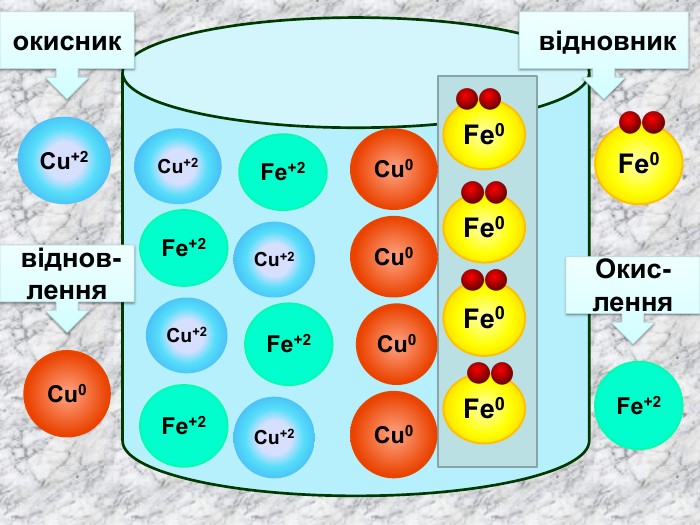



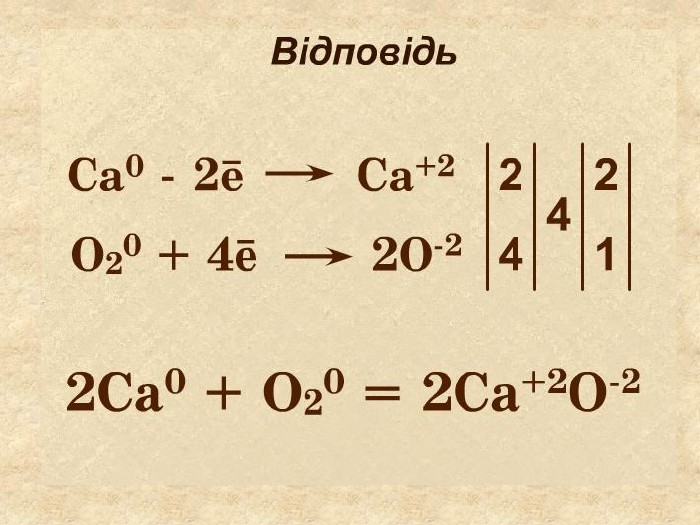



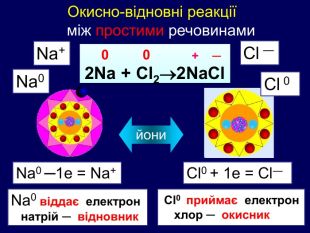
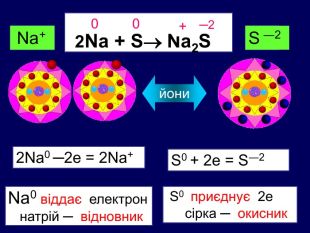
Елементи, віддаючи електрони— окиснюються і перетворюються на позитивно заряджені йони, які ще називають аніони. Теоретичні викладки. Запис Na0 – 1e Na+ означає, що атом “позбувся” електронів перетворився у позитивно заряджений йон. Зверху над ним пишеться цифра відданих електронів і ставиться знак + (атом позбувся лиш один електрон то ставиться просто + і число одиниця не пишеться). Про кількість відданих електронів свідчить значок, якого пишуть зверху над символом елемента. Цей значок називається ступінь окиснення. Приклади: Na+ Н+;
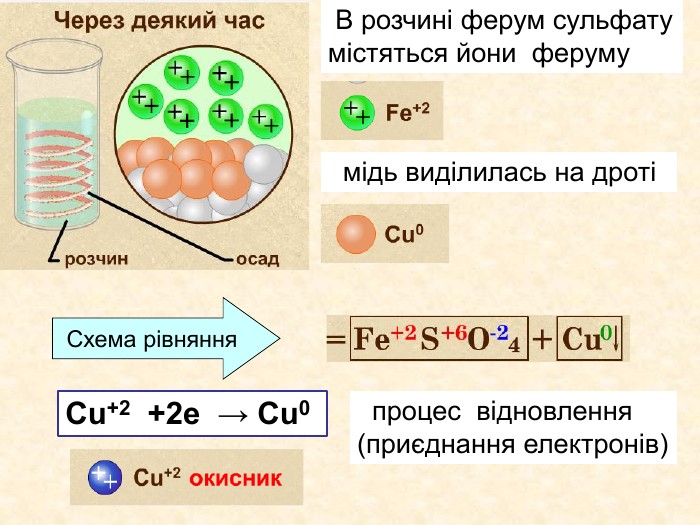
Теоретичні викладки Інші елементи якім не вистачає електронів до вісьми на зовнішньому шарі приєднують їх і перетворюються на негативно заряджені йони, які ще називають катіони. Елементи, що приєднали електрони — відновлюються. Запис О0 + 2е О ─2 означає, що атом, “приєднав” електрони перетворився у негативно заряджений йон. Зверху над ним пишеться цифра приєднаних електронів і знак мінус.(якщо атом приєднав один електрон, то ставиться знак мінус, одиниця не пишеться). Приклад: Cl ─ S ─2
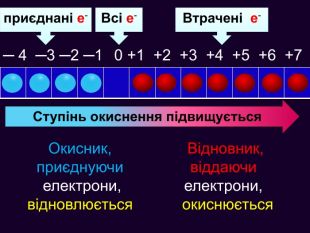
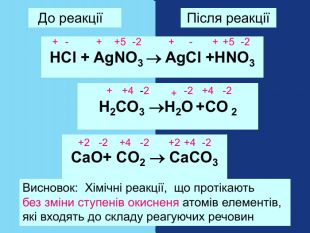
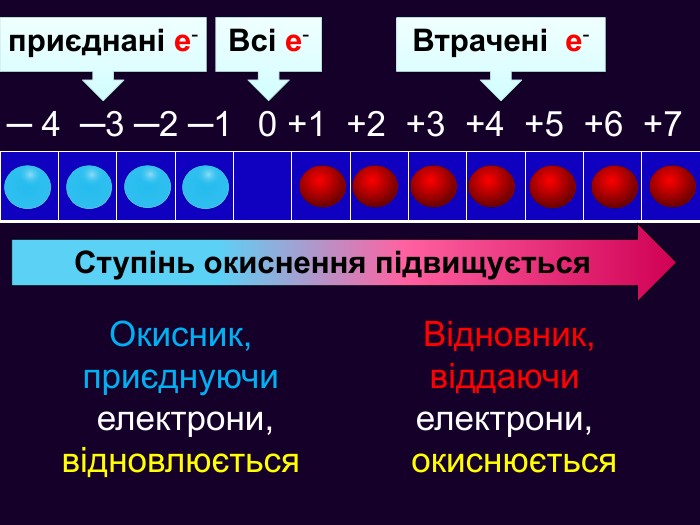
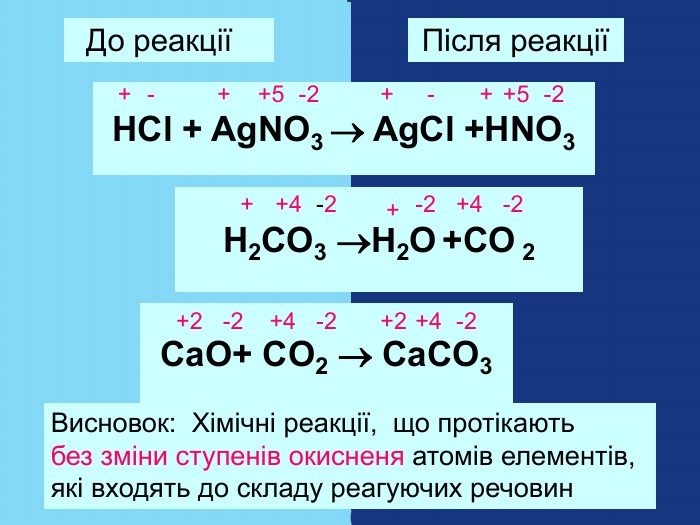
Якщо атом не віддавав і не приєднував електрони то ставиться нуль. Атоми простих речовин електронейтральні. Їх ступінь окиснення дорівнює нулю. Наприклад: Сl02 ; О02; Н02 При збільшенні числа втрачених електронів ступінь окиснення збільшується аж до максимально можливої коли відсутні всі валентні електрони. Приєднані електрони Втрачені електрони – 4 – 3 – 2 –1 0 +1 +2 +3 +4 +5 +7 ступінь окиснення збільшуються
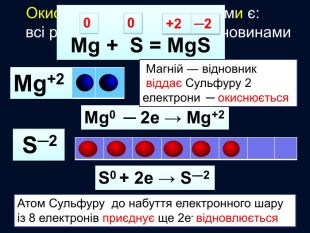
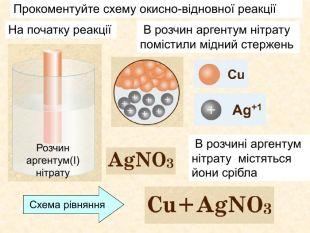
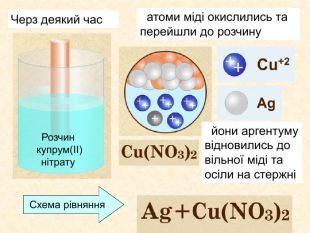
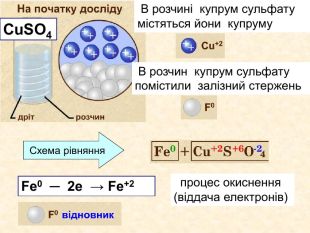
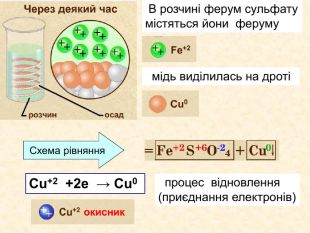
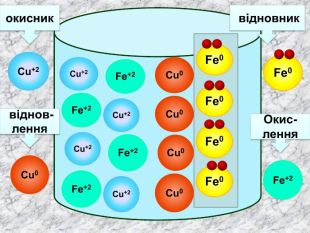
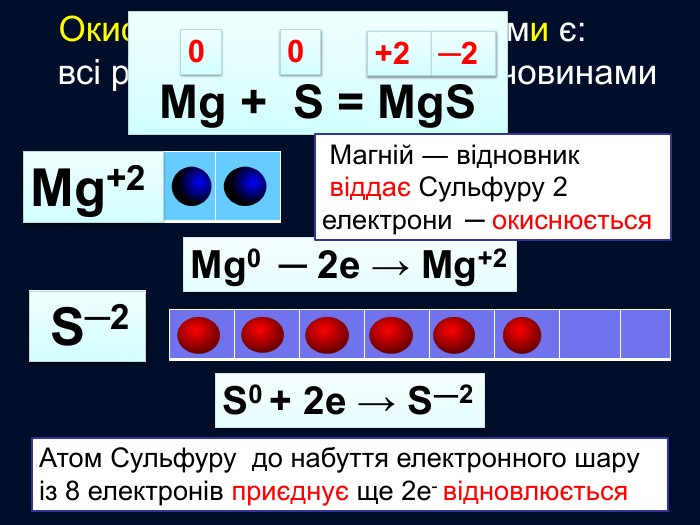
Окисно-відновними реакціями є: всі реакції між простими речовинами{21 E4 AEA4-8 DFA-4 A89-87 EB-49 C32662 AFE0}Mg + S = Mg. S00+2─2{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}++ Mg0 Mg0 ─ 2е → Mg+2 Магній ― відновник віддає Сульфуру 2 електрони ─ окиснюється S0 S0 + 2е → S―2 Атом Сульфуру до набуття електронного шару із 8 електронів приєднує ще 2е- відновлюється Mg+2 S─2
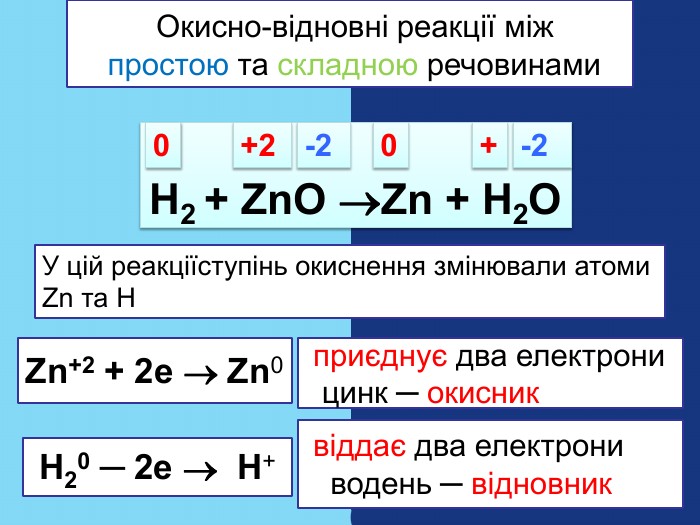
Що відбувається з атомом гідрогену ? Що відбувається з атомом цинку?Які атоми змінили ступінь окиснення? Zn + 2 HСlZn. Cl2 +H2++200 У цій реакції ступінь окиснення змінювали атоми Zn та H Zn0 ─ 2е Zn+2 2 Н+ + 2е Н0 Zn0 віддає два електрони цинк ─ відновник Н+2 приймає два електрони водень ─ окисник─ Окисно-відновні реакції між простою та складною речовинами─
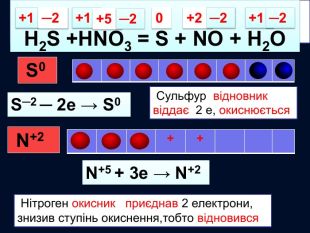
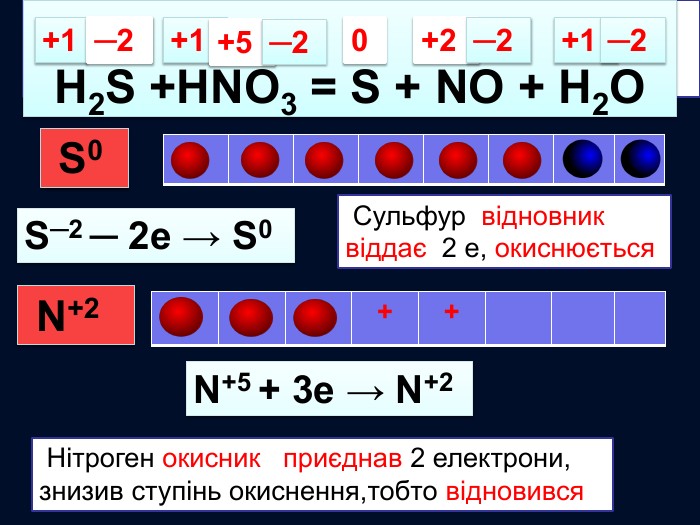
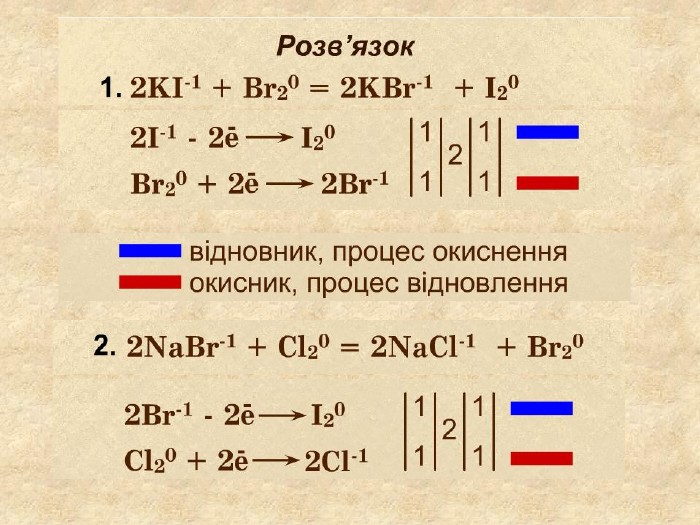
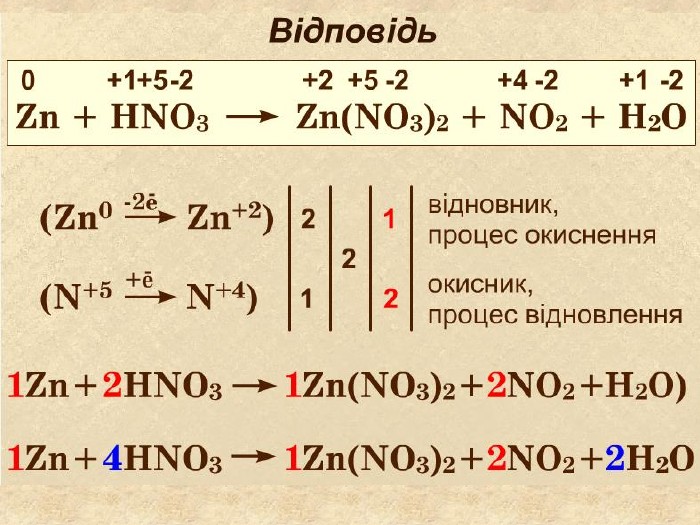
S─2 Окисно-відновні реакції між складними речовинами{21 E4 AEA4-8 DFA-4 A89-87 EB-49 C32662 AFE0}H2 S +HNO3 = S + NO + H2 O0+1+2─2 S0 S─2 ─ 2е → S0 Сульфур відновник віддає 2 е, окиснюється. N+5 + 3е → N+2 Нітроген окисник приєднав 2 електрони, знизив ступінь окиснення,тобто відновився N+5 ─2+1+5─2+1─2{21 E4 AEA4-8 DFA-4 A89-87 EB-49 C32662 AFE0}+++++ N+2 style.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
H2 S + HNO3 = S + NO + H2 O S─2 ─ 2е → S0 N+5 + 3е → N+2 окисленнявідновлення6 Найменше спільне кратне для кількості відданих відновником електронів та електронів, приєднаних окисником ─ 66 : 2 = 336 : 3 = 22 Проставляють коефіцієнти перед тречовинами згідно з електронним балансом32 4
Григорович О. В. Хімія: підруч. для 9 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2017 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Строойтова І. Ю. Усі уроки імії. 9 клас ̶ Х.: вид. група «Основа», 2009 Абрамович С.І. Левитська О. В. Хімія. Розвязування задач, відповіді на питання, підказки до практичних робіт до підручника Н. М. Буринської Харків: Веста 2002 Джерела


про публікацію авторської розробки
Додати розробку