Презентація "Оксиди"
Про матеріал
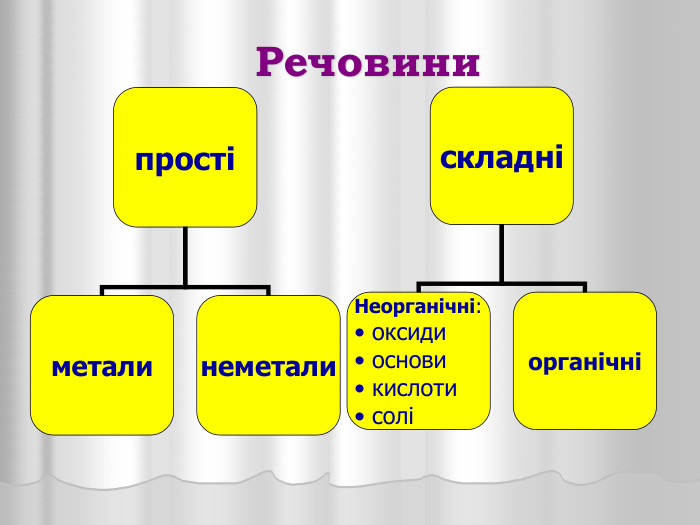
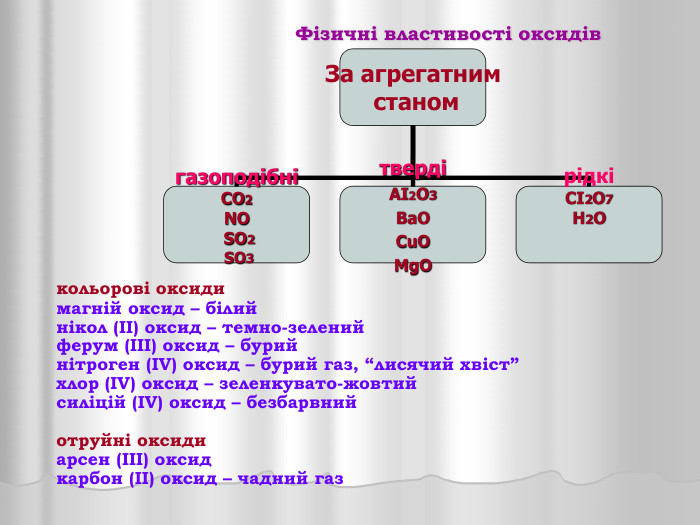
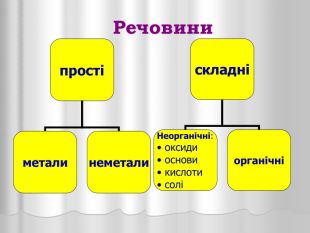
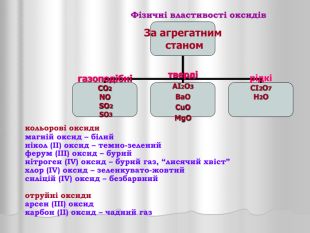
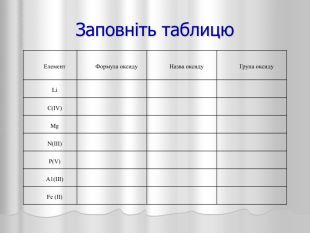
Презентація до уроку хімії з теми "Оксиди" у 8 класі. Може бути використана як вчителями при проведенні уроків, так і учнями при опрацювання даної теми. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку