Презентація "Основи. Фізичні та хімічні властивості"
Про матеріал
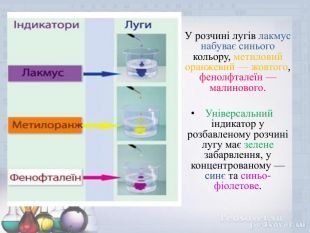
Презентація "Основи. Фізичні та хімічні властивості" допоможе вчителю у підготовці та проведенню уроку з даної теми, учням -засвоїти навчальний матеріал з даної теми. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку