Презентація "Визначення загальної (титрованої) кислотності"




















Використання показника титрованої кислотностї У виробництві: молока і молочних продуктів; жирів, майонезів;зерна, круп, борошна, макаронних, хлібобулочних та кондитерських виробів; продуктів переробки плодів та овочів;вин, соків плодово-ягідних;безалкогольних напоїв, сиропів, квасів;харчових концентратів;вершкового масла, маргарину;яєчних продуктів;кулінарних виробів та напівфабрикатів з рубленого м’яса;консервів та пресервів з риби.
Використання показника титрованої кислотностї У виробництві визначення показника кислотності дозволяє:підтвердити відповідність якості харчової продукції вимогам нормативних документів; дотриматись рецептури виробництва продукції; визначити ступінь готовності напівфабрикатів та харчових продуктів (закваски, рідких дріжджів, квашеної капусти та ін.); встановити мікробіологічну безпеку (мікробіологічне псування сировини і готової продукції супроводжується утворенням органічних кислот та підвищенням кислотності); використати консерванти (для продовження терміну зберігання при пригніченні життєдіяльності сторонніх мікроорганізмів).
Ситуація “Новизни інформації”{E8 B1032 C-EA38-4 F05-BA0 D-38 AFFFC7 BED3}Кислотність молока, ˚ТХарактеристика молока (по Давидову Р. Б.)Нижче 15 Молоко фальсифіковане чи отримане від хворих корів або корів у кінці лактації16-18 Нормальне свіже молоко20-21 Молоко першого місяця лактації22 Молоко кислувате, але при кип’ятінні не скипається26 При кип’ятінні молоко може скипітися28 При кип’ятінні скипається30 Зсідається при нагріванні до температури 77˚С40 Те саме до 65˚С50 Те саме до 40˚С60 Зсідається самовільно при температурі 22˚С65 Те саме при 16˚СТаблиця 1 Зміна якості молока залежно від кислотності
Професійне спілкування: У чому суть титриметричного аналізу? Титриметричний аналіз заснований на точному вимірюванні об'єму розчину реагенту з відомою концентрацією, необхідного для взаємодії з аналізованою речовиною. Вміст аналізованої речовини знаходять за кількістю витраченого на реакцію з нєю реагенту. Який закон становить основу титриметричного аналізу? Основу титриметричного аналізу становить закон еквівалентів: речовини взаємодіють між собою у кількостях, пропорційних їх еквівалентним масам. Основна розрахункова формула методу: СN1V1= СN2V2 Які операції титриметричного аналізу є найголовнішими? Найголовнішими операціями титриметричного аналізу є: - приготування робочих (титрованих) розчинів; - вимірювання їх об’ємів; - процес титрування.
Якій розчин називають робочим (титрованим, титрантом)?н Робочий (титрований, титрант) – розчин реактиву з точно відомою концентрацією. Як визначають точний об’єм розчинів?точний об’єм розчинів?Точні об'єми розчинів в титриметричному аналізі визначають за допомогою вимірювального посуду – мірних колб, піпеток та бюреток. Що таке титрування? Титрування – процес поступового додавання титрованого (титранту) розчину до розчину визначуваної речовини. Які два види титрованих розчинів використовують в титриметричному аналізі? В титриметричному аналізі використовують два види титрованих розчинів: стандартні (первинні стандарти) та стандартизовані (вторинні стандарти). Професійне спілкування:
Професійне спілкування: Що таке стандартний розчин? Стандартний розчин одержують шляхом розчинення точної наважки чистої речовини у потрібному об’ємі розчинника. Знаючи масу розчиненої речовини і об’єм одержаного розчину, обчислюють його концентрацію. Що таке стандартизований розчин? ндартизований Стандартизовані розчини спочатку готують з приблизною потрібною концентрацією, а потім уточнюють її шляхом титрування розчином з уже відомою концентрацією. Коли припиняють титрування? Титрування ведуть до досягнення точки еквівалентності – моменту титрування, коли кількість реактиву (титранта) еквівалентна кількості досліджуваної речовини.
Професійне спілкування: Як встановити точку еквівалентності?еквівалентності? Точку еквівалентності встановлюють візуально за зміною кольору індикаторів - речовин, які за певних умов змінюють забарвлення, а також інструментально. Вибір індикатору залежить від типу реакції. Як поділяють методи об’ємного аналізу за типом хімічних реакцій? Методититриметричного аналізу. Методкислотно-основноготитрування Методокисно-відновноготитрування Методосадження Методкомплексо-утворення
Яка реакція лежить в основі методу кислотно-основного титрування (методу нейтралізації)? в основі метод В основі методу реакція між кислотами і лугами, яка відбувається між іонами Н+ та ОН- з утворенням води. Кількісне визначення яких речовин можна проводити методом кислотно-основного титрування? Методом кислотно-основного титрування проводять кількісне визначення кислот, основ та гідролітично кислих і гідролітично лужних солей. Які індикатори використовують при кислотно-основному титруванні? Кислотно-основні (р. Н-індикатори), які змінюють забарвлення при зміні реакції середовища. Професійне спілкування:
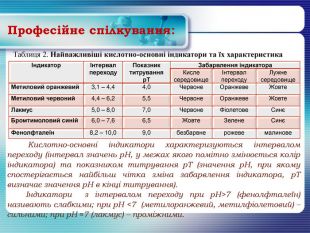
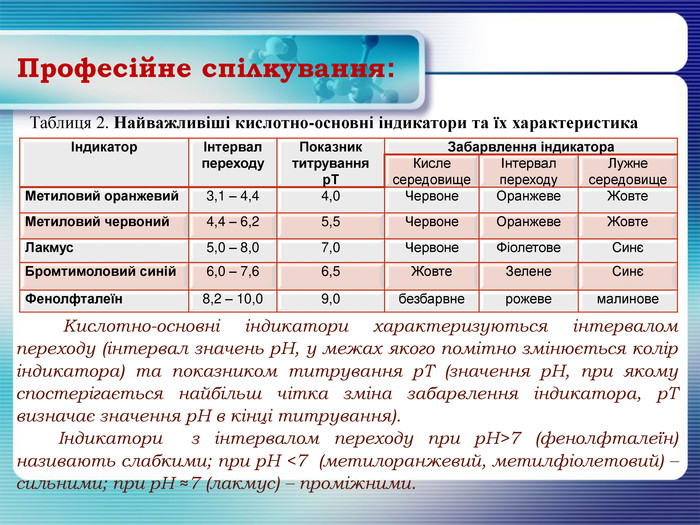
Професійне спілкування:{5 DA37 D80-6434-44 D0-A028-1 B22 A696006 F}ІндикаторІнтервал переходу. Показник титруванняр. ТЗабарвлення індикатора. Кисле середовищеІнтервал переходу. Лужне середовище. Метиловий оранжевий3,1 – 4,44,0 Червоне. Оранжеве. Жовте. Метиловий червоний4,4 – 6,25,5 Червоне. Оранжеве. Жовте. Лакмус5,0 – 8,07,0 Червоне. Фіолетове. СинєБромтимоловий синій6,0 – 7,66,5 Жовте. Зелене. СинєФенолфталеїн8,2 – 10,09,0безбарвнерожевемалинове. Таблиця 2. Найважливіші кислотно-основні індикатори та їх характеристика Кислотно-основні індикатори характеризуються інтервалом переходу (інтервал значень р. Н, у межах якого помітно змінюється колір індикатора) та показником титрування р. Т (значення р. Н, при якому спостерігається найбільш чітка зміна забарвлення індикатора, р. Т визначає значення р. Н в кінці титрування). Індикатори з інтервалом переходу при р. Н>7 (фенолфталеїн) називають слабкими; при р. Н <7 (метилоранжевий, метилфіолетовий) – сильними; при р. Н ≈7 (лакмус) – проміжними.
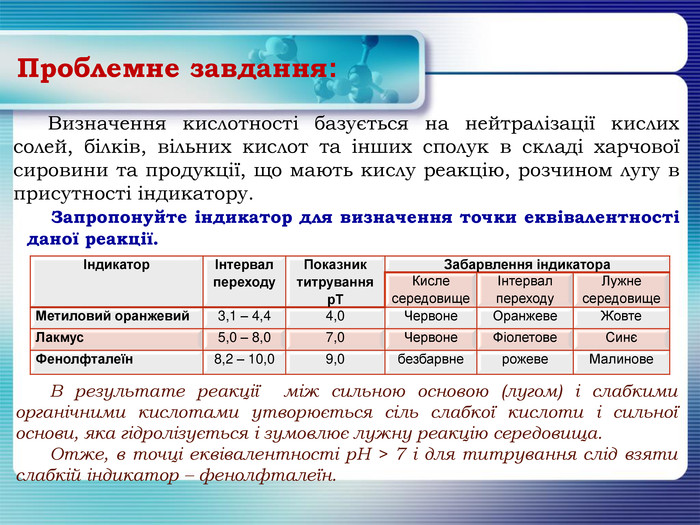
Визначення кислотності базується на нейтралізації кислих солей, білків, вільних кислот та інших сполук в складі харчової сировини та продукції, що мають кислу реакцію, розчином лугу в присутності індикатору. Запропонуйте індикатор для визначення точки еквівалентності даної реакції. Проблемне завдання: В результате реакції між сильною основою (лугом) і слабкими органічними кислотами утворюється сіль слабкої кислоти і сильної основи, яка гідролізується і зумовлює лужну реакцію середовища. Отже, в точці еквівалентності р. Н > 7 і для титрування слід взяти слабкій індикатор – фенолфталеїн.{5 DA37 D80-6434-44 D0-A028-1 B22 A696006 F}ІндикаторІнтервал переходу. Показник титруванняр. ТЗабарвлення індикатора. Кисле середовищеІнтервал переходу. Лужне середовище. Метиловий оранжевий3,1 – 4,44,0 Червоне. Оранжеве. Жовте. Лакмус5,0 – 8,07,0 Червоне. Фіолетове. СинєФенолфталеїн8,2 – 10,09,0безбарвнерожеве. Малинове
Проблемне завдання. Для визначення кислотності молока методом кислотно-основного титрування використовують робочий розчин натрій гідроксиду. Скільки грамів натрій гідроксиду (Na. ОН) потрібно взяти для приготування 250 см3 0,1 н розчину? m(Na. ОН) = CN(Na. ОН) VMекв(Na. ОН) = 0,1н 0,25л 40г/моль= 1г. Що означає вираз “0,1 н розчин Na. OH”?0,1 Мекв(Na. OH) = 0,1 М(𝑁𝑎𝑂𝐻)𝐸=0,1 40г/моль1 = 4 г/л. Для приготування 0,1 н розчину натрій гідроксиду необхідно взяти 4 г Na. OH на 1 л води.
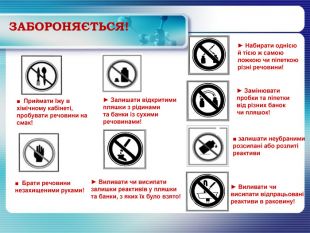
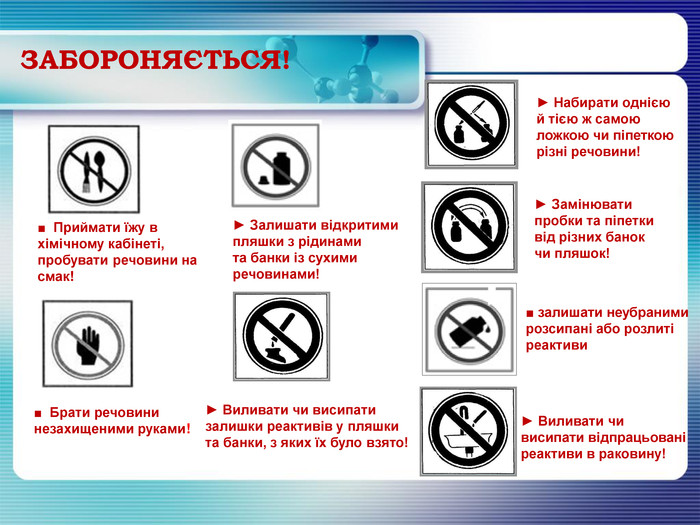
ЗАБОРОНЯЄТЬСЯ!► Виливати чи висипати відпрацьовані реактиви в раковину!► Виливати чи висипатизалишки реактивів у пляшки та банки, з яких їх було взято!► Замінювати пробки та піпетки від різних банок чи пляшок!► Набирати однієюй тією ж самоюложкою чи піпеткоюрізні речовини!► Залишати відкритимипляшки з рідинамита банки із сухимиречовинами!■ Приймати їжу вхімічному кабінеті,пробувати речовини на смак!■ Брати речовини незахищеними руками!■ залишати неубраними розсипані або розлитіреактиви
Дослід 1. Визначення кислотності молока У конічну колбу на 100-250 см3 відміряти 10 см3 добре перемішаного молока. Додати 20 см3 дистильованої води та 3 краплі фенолфталеїну, добре перемішати. Титрувати 0,1 н розчином лугу (Na. OH) до появи рожевого забарвлення, яке не зникає впродовж 1 хв. Результати дослідження обчислити за формулою: Х = 𝑽∙𝑪𝑵∙𝟏𝟎𝟎𝟎,𝟏∙ 𝑽𝟏,де: Х – градуси кислотності;V- об’єм розчину лугу (Na. OH), який затрачено на титрування, см3;CN - молярна концентрація еквівалента лугу, мольекв/л;0,1–коефіцієнт для перерахунку на к-сть см3 0,1н розчину лугу;V1 – об’єм молока, узятого для аналізу, см3.100 - об’єм молока см3, на який потрібно розрахувати градуси кислотності.
Дослід 2. Визначення кислотності борошна Зважити 5 г борошна з точністю ± 0,01. Насипати у конічну колбу, в яку заздалегідь налити за допомогою мірного циліндра 50 см3 дистильованої води. Збовтати, додати 5 крапель фенолфталеїну та титрувати 0,1 н розчином їдкого натрію (Na. OH) до появи рожевого забарвлення, що не зникає протягом 1 хв. Кислотність борошна К, град, розрахувати за формулою: К = 𝑽∙𝟏𝟎𝟎∙𝒌𝑮∙𝟏𝟎, де V–об’єм розчину лугу (Na. OH), який затрачено на титрування,см3;G – маса наважки борошна, г; k – поправочний коефіцієнт до 0,1 моль/дм3 розчину гідроксиду натрію (приймається k = 1); 100 – перерахунок на 100 г продукту; 1/10 – коефіцієнт перерахунку 0,1 моль/дм3 розчину гідроксиду натрію на 1 моль/дм3 .
Відібрати 10 см3 фільтрату у мірну колбу місткістю 50 см3. Вміст колби довести до мітки дистильованою водою і перемішати. Відібрати піпеткою 10 см3 розчину у конічну колбу для титрування, додати 3-5 краплі розчину фенолфталеїну і титрувати 0,1 н розчином натрій гідроксиду до появи рожевого забарвлення, що не зникає на протязі 30 с. Дослід 3 Визначення кислотності яблучного соку Титровану кислотність у % яблучної кислоти розрахувати за формулою: Х% = 𝑉(𝑁𝑎𝑂𝐻)∙𝐾∙𝑉(50)𝑉(10)∙𝑉(10)∙100де V(Na. OH) – об’єм лугу, витрачений на титрування, см3;K(кислоти)–коефіцієнт перерахунку на яблучну кислоту, К=0,0067;V(50) – об’єм колби; см3 V(10) – об’єм досліджувальної проби, см3;V(10) – об’єм, взятий на титрування, см3.
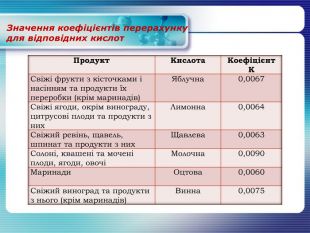
Значення коефіцієнтів перерахунку для відповідних кислот{16 D9 F66 E-5 EB9-4882-86 FB-DCBF35 E3 C3 E4}Продукт. Кислота Коефіцієнт КСвіжі фрукти з кісточками і насінням та продукти їх переробки (крім маринадів)Яблучна0,0067 Свіжі ягоди, окрім винограду, цитрусові плоди та продукти з них. Лимонна0,0064 Свіжий ревінь, щавель, шпинат та продукти з них. Щавлева0,0063 Солоні, квашені та мочені плоди, ягоди, овочіМолочна0,0090 Маринади Оцтова 0,0060 Свіжий виноград та продукти з нього (крім маринадів)Винна0,0075
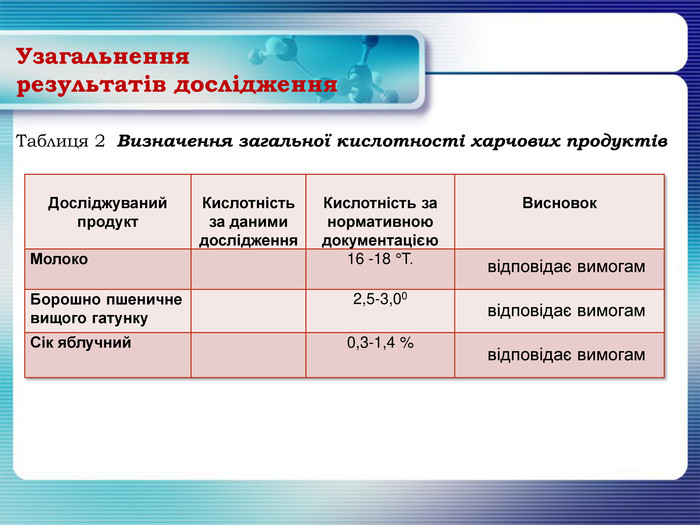
Узагальнення результатів дослідження {16 D9 F66 E-5 EB9-4882-86 FB-DCBF35 E3 C3 E4}Досліджуваний продукт. Кислотність за даними дослідження. Кислотність за нормативною документацією. Висновок. Молоко 16 -18 °Т. Борошно пшеничневищого гатунку 2,5-3,00 Сік яблучний 0,3-1,4 % Таблиця 2 Визначення загальної кислотності харчових продуктів відповідає вимогам відповідає вимогам відповідає вимогам
Рефлексія“Складання сенкану”. 1-й рядок. Іменник (тема). Кислотність. 2-й рядок. Два прикметники (яка вона?) Титрована. Загальна.3-й рядок. Три дієслова (що вона робить?) Зумовлює (смакові властивості харчових продуктів). Підтверджує (відповідність якості харчової продукції нормативним вимогам). Визначає (ступінь готовності напівфабрикатів та харчових продуктів). Встановлює (мікробіологічну безпеку). 4-й рядок. Фраза-висновок з чотирьох слів. Титрована (загальна) кислотнність – показник якості, свіжості та сортності продукції.5-й рядок. Іменник-синонім до теми. Якість. Свіжість.
Домашнє завдання 1. Повторити тему “Титрометричний аналіз. Кислотно-основне титрування.”Сегеда А. С. Аналітична хімія. Якісний і кількісний аналіз. с.140-170 Барсукова З. А. Аналитическая химия. с.190-218.2. Виконати завдання для корекції знань, вмінь, навичок в зошті для ЛПЗ.3. Розв’язати задачі: Для визначення кислотності молока методом кислотно-основноготитрування використовують робочий розчин натрій гідроксиду. Скільки грамів натрій гідроксиду (Na. ОН) потрібно взяти для приготування 500 мл 1 н розчину?На нейтралізацію 24,50 см3 розчину Н2 SO4 використано 23,00 см3 0,1500 н. розчину КOH. Обчислити масу Н2 SO4, яка міститься в 500 мл розчину. Творче завдання. Підготувати презентацію “Застосування кислотно-основного титрування в технохімічному контролі харчових виробництв”.


про публікацію авторської розробки
Додати розробку