Презентація «Періодична система хімічних елементів» 8 клас
| Презентація допоможе учням та вчителю при проведенні уроку на тему: «Періодична система хімічних елементів, її структура». |

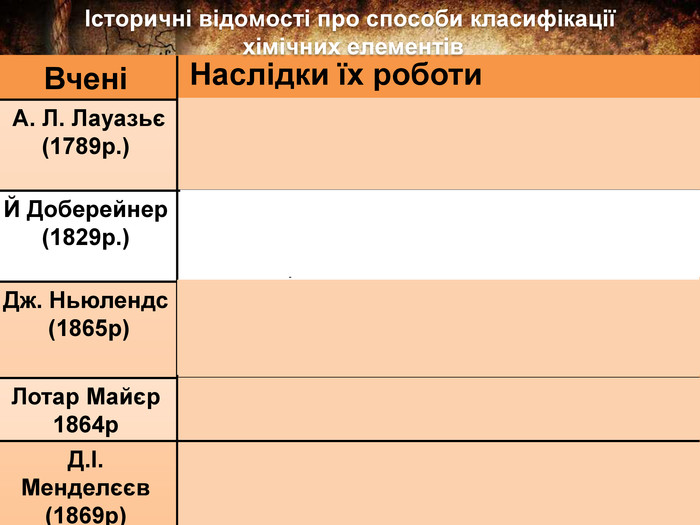














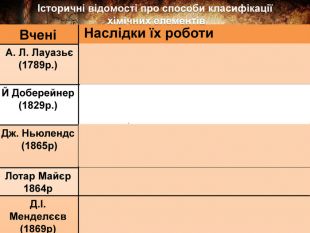
{08 FB837 D-C827-4 EFA-A057-4 D05807 E0 F7 C}Вчені Наслідки їх роботи А. Л. Лауазьє (1789р.)Запропонував першу класифікацію простих речовин на метали і неметали, а отже, елементів—металічних і неметалічних. Й Доберейнер (1829р.)Об’єднав елементи за схожими властивостями утворених ними речовин. Виділив тріади подібних елементів. Дж. Ньюлендс (1865р)Розмістив відомі йому 56 елементів у ряд за зростанням їх атомних мас і помітив закономірність яку назвали правилом октав. Лотар Майєр 1864р. Розмістив елементи за зростанням атомних мас і розділив на 6 груп за валентністю. Д.І. Менделєєв (1869р)На основі відкритого ним Періодичного закону створив наукову класифікацію хім. елементів — Періодичну системуІсторичні відомості про способи класифікації хімічних елементів
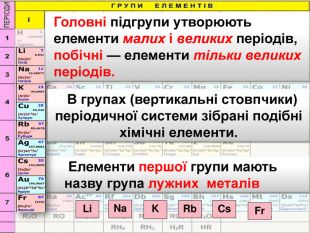
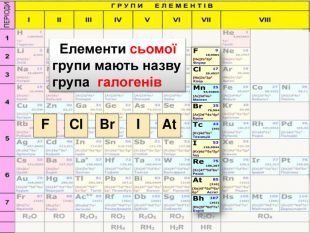
Що було покладено в основу класифікації елементів до Д.І. Менделєєва?В основу класифікації хімічних елементів на металічні та неметалічні спочатку було покладено схожість фізичних властивостей простих речовин Що було виділено на підставі схожості властивостей елементів та їх сполук?Що не було відображено в класифікаціях вчених хімічних елементів?природні родини лужних металів, галогенів, інертних газів.не відоюбраєався зв’язок між окремими групами елементів
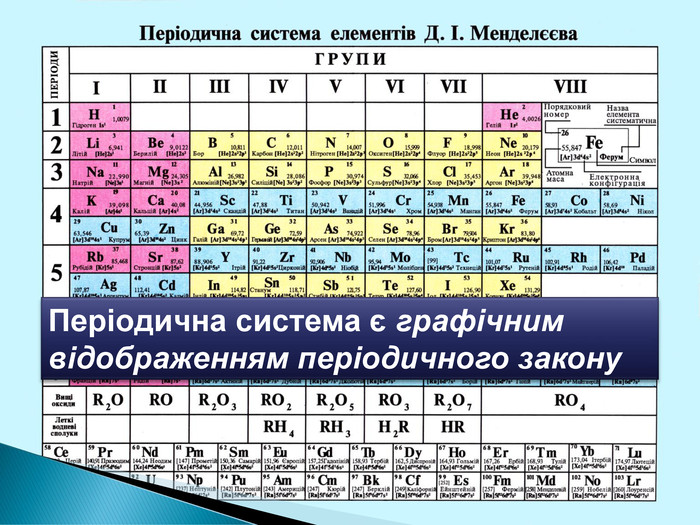
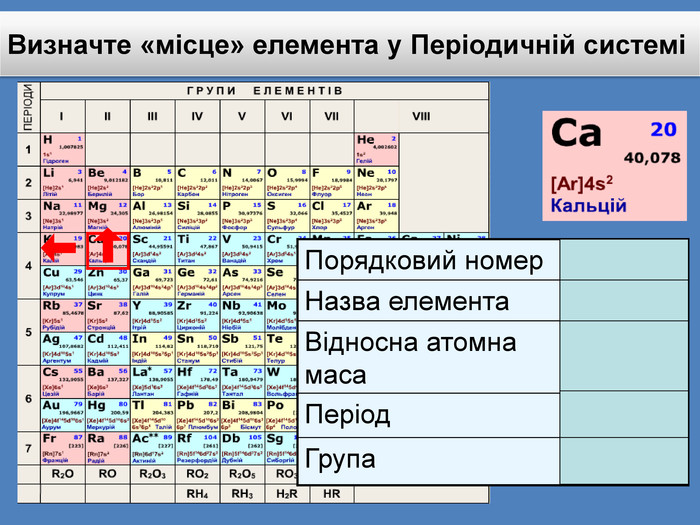
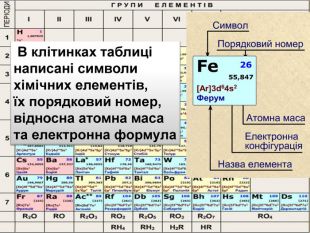
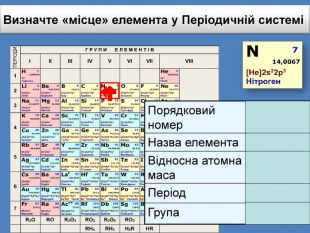
Li 7 Be 9 B 11 C 12 N 14 O 16 Ne 20 F 19 Na 23 Mg 24 Al 27 Si 28 P 30 S 32 Cl 35 Ar 40 K 39 Ca 40 Br 79 Kr 84 За основу систематизації хімічних елементів Д.І. Менделєєв обрав відносну атомну масу. Д. І. Менделєєв картки із записами символів хімічних елементів розмістивпорядку зростання відносних атомних мас наданий елементу номер отримав назву порядковий номер елемента
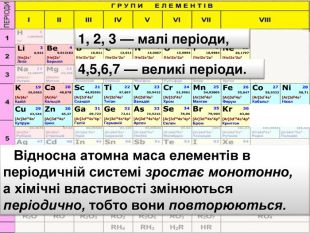
Десятим елементом є інертний елемент Неон, який не реагує ні з воднем ні з металами і за своїми властивостями нагадує елемент Гелій. Li 7 Be. B 11 C 12 N 14 O 16 Ne 20 F 19 Na 23 Mg 24 Al 27 Si 28 P 30 S 32 Cl 35 Ar 40 K 39 Ca 40 Br 79 Kr 84 У ряду від Літію до Флуору виявляється поступова зміна властивостей від металу до неметалу. Далі така послідовність у зміні властивостей різко обривається. З’являється елемент Натрій, який за своїми властивостями подібний до першого елемента ряду — Літію. Тобто через проміжок у вісім елементів властивості повторилися.
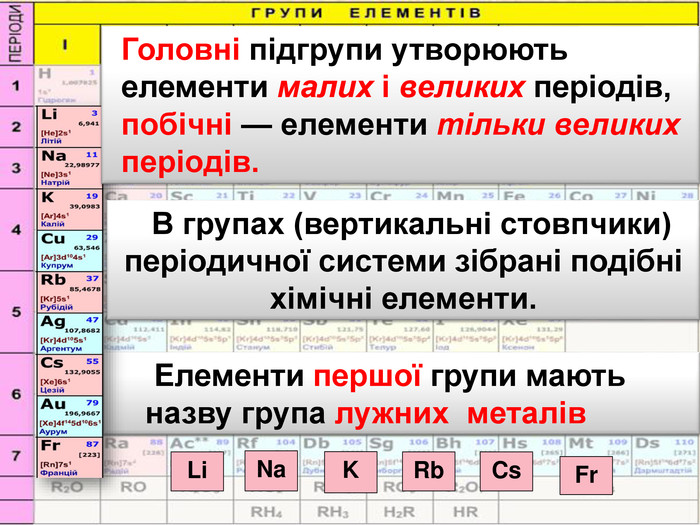
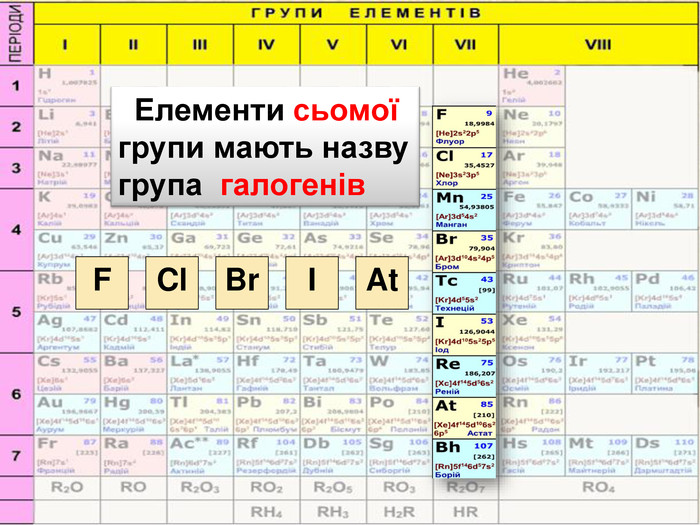
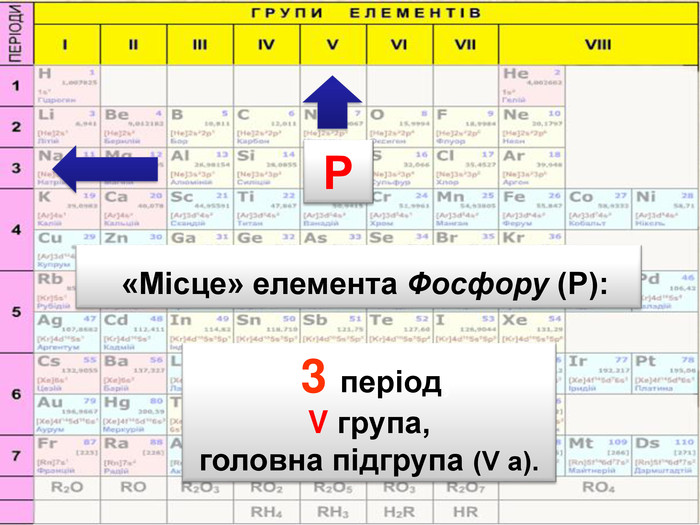
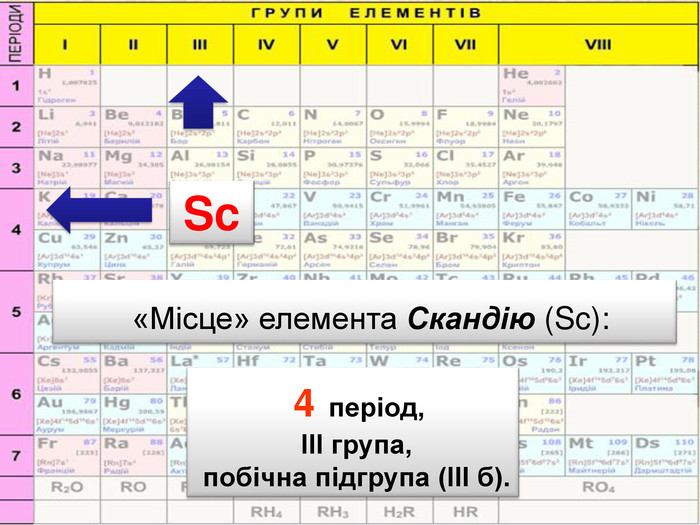
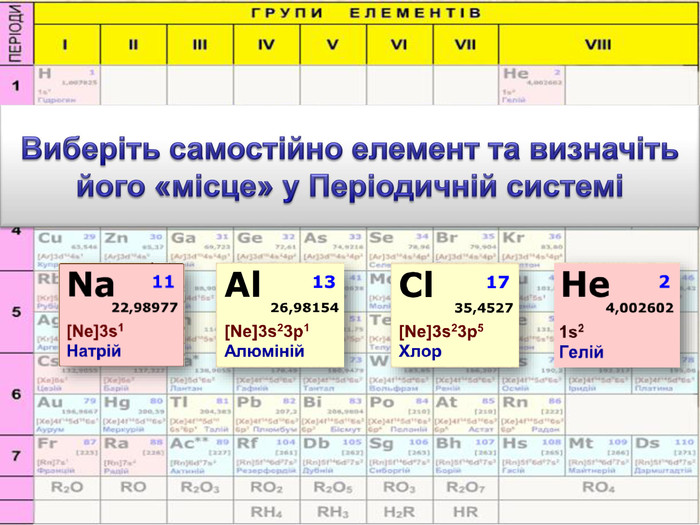
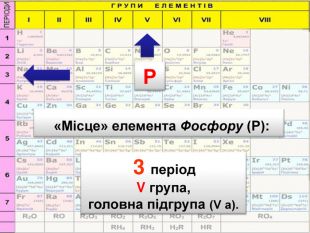
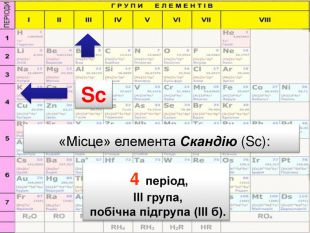
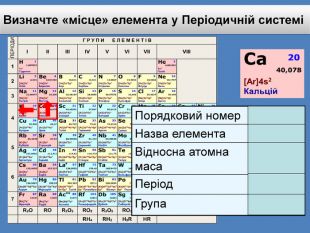
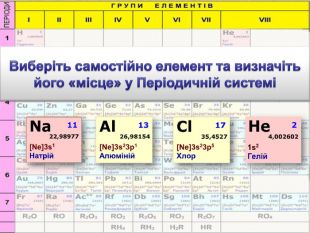
До беріть період та групу таким елементам{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F} Фосфоргрупа. VХлоргрупа. VIIперіод3період3{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}Купрумгрупа. IАлюмінійгрупа. IIIперіод4період3{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}Завдання: Складіть формули оксидів таких елементів та назвіть їх. С(ІV)С (ІІ)Р(V)Fe (ІІІ)S (ІV)S(VI)Р2 O5 СО2 СО Fe2 O3 SO 2 SO3 Завдання: Написати формули летких водневих сполук для таких елементів: Si, N, S, Cl{18603 FDC-E32 A-4 AB5-989 C-0864 C3 EAD2 B8}Si. H4 NH3 H2 SHCl
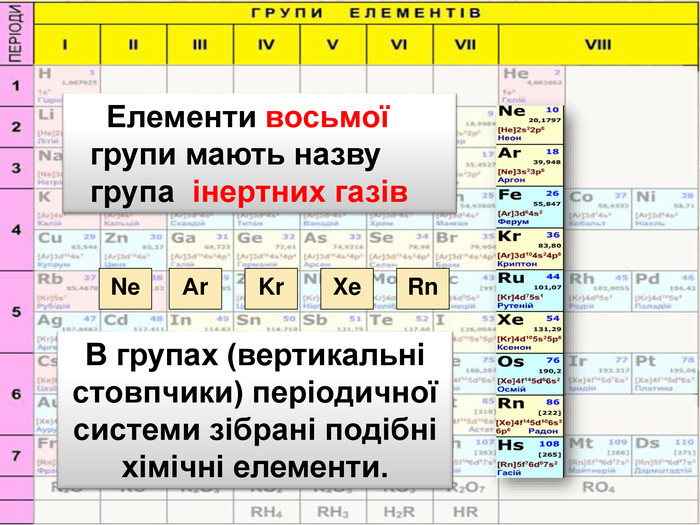
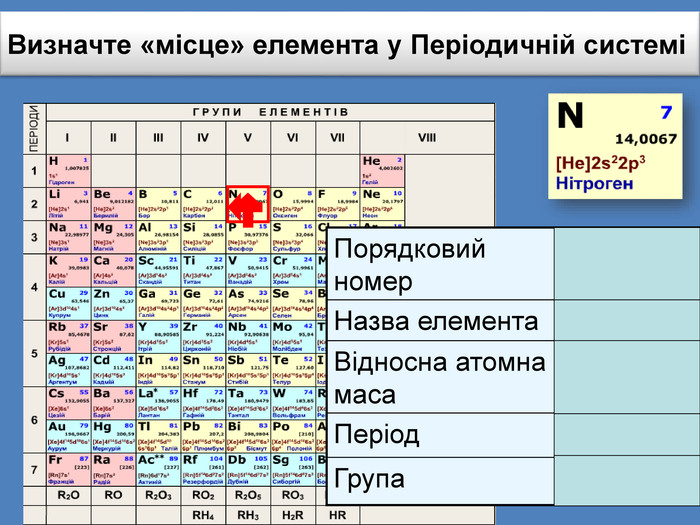
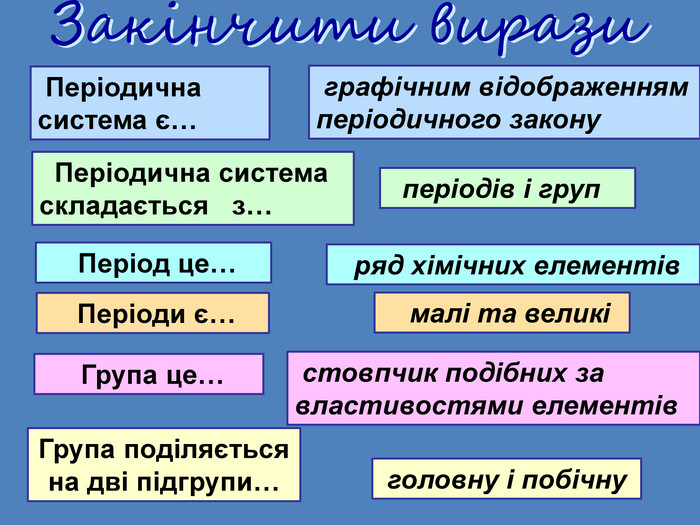
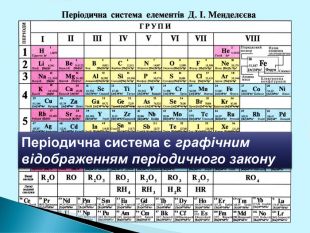
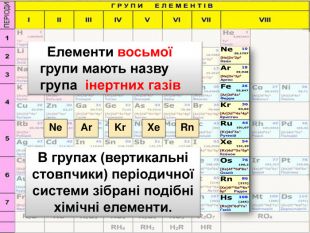
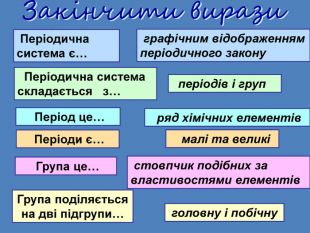
Періодична система є… графічним відображенням періодичного закону Періодична система складається з… періодів і груп Період це… ряд хімічних елементів Періоди є… малі та великі Група це… стовпчик подібних за властивостями елементів. Група поділяється на дві підгрупи…головну і побічну. Закінчити вирази
Джерела. Григорович О. В. Хімія: підруч. для 8 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2016 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Данильченко В.Є Халімон Є. В. Хімія. Навчальний посібник. 8-9 класи – Харків.: Країна мрій, 2008. – 128с.


про публікацію авторської розробки
Додати розробку














-

Теребіленко Людмила Володимирівна
10.09.2023 в 16:01
Дякую за презентацію. Ви - в цій справі найкращий.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
20.09.2022 в 21:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

RU Vladimir
20.09.2022 в 08:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гурєєва Ольга В'ячеславівна
12.10.2021 в 19:11
Вже не вперше дякую Вам за чудові презентації. Із великим задоволенням користуюся Вашим матеріалом.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коротницкий Владимир
05.10.2021 в 23:23
Спасибо за прекрасно поданный материал !!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лисенко Надія Ол.
22.09.2020 в 23:03
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 3 відгука