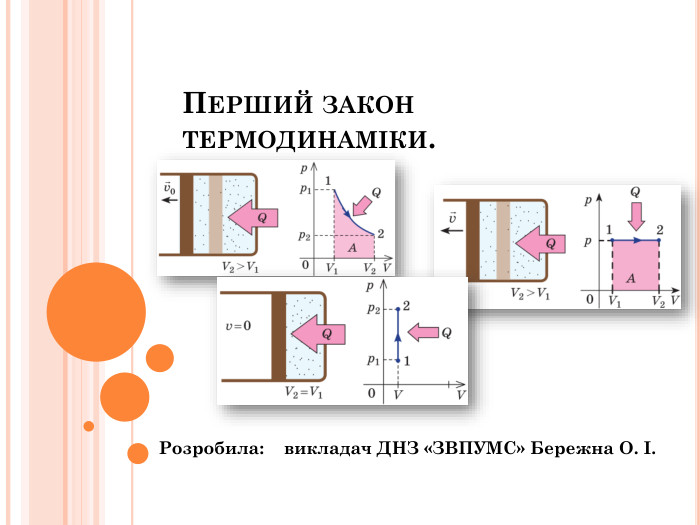
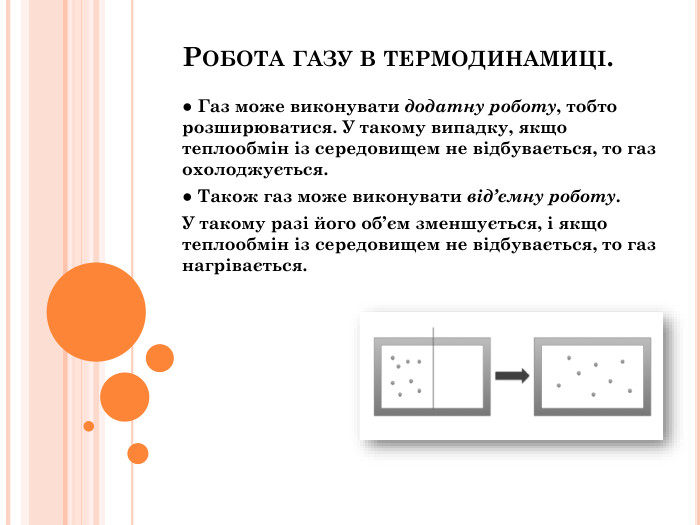
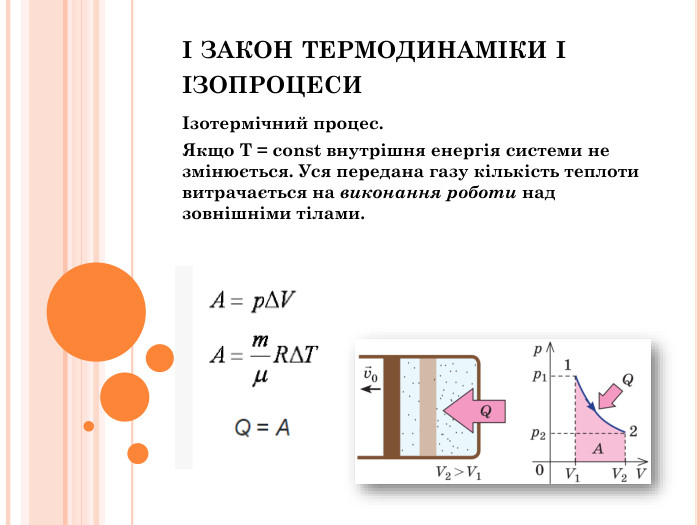
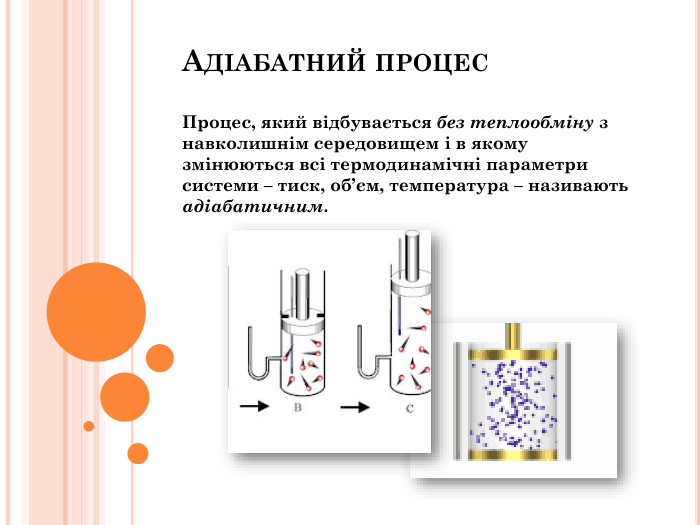
Презентація "Перший закон термодинаміки"
Про матеріал
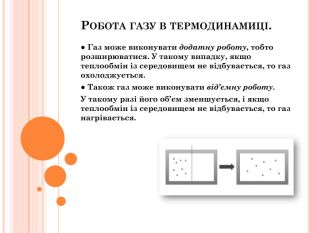
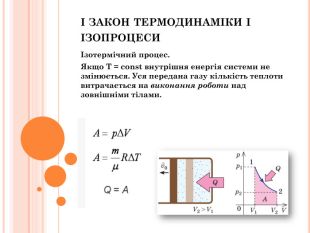
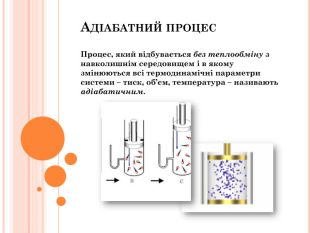
Презентація містить інфомацію згідно теми уроку. Фомує за закріплює поняття йзопроцесів, термодинамічних велечин, адіабатний процес його приклади і застосування. Матеіал може бути використаний як викладачами так і учнями для самостійної роботи . Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку