Презентація по темі: "Алотропія. Алотропні модифікації речовин неметалічних елементів."


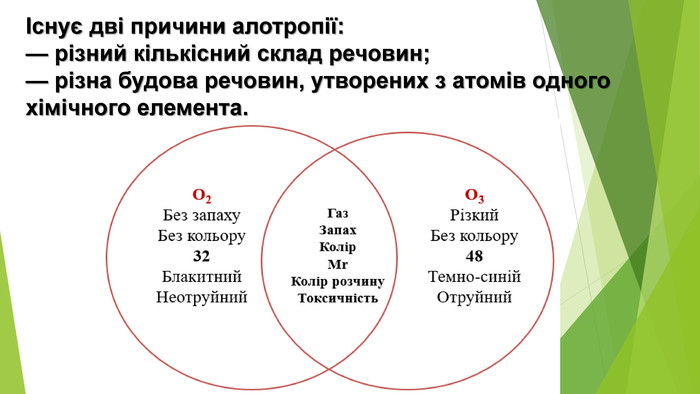






















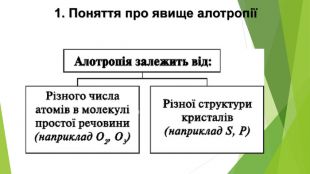
Алотропія. Алотропні модифікації речовин неметалічних елементів. Алотропія (від гр. ἄλλος, állos — інший і τρόπος, trópos — властивість) - явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою. Термін увів Я. Берцеліус у 1841 р. Алотропія — існування одного хімічного елемента у вигляді кількох простих речовин (алотропних модифікацій або алотропних форм).
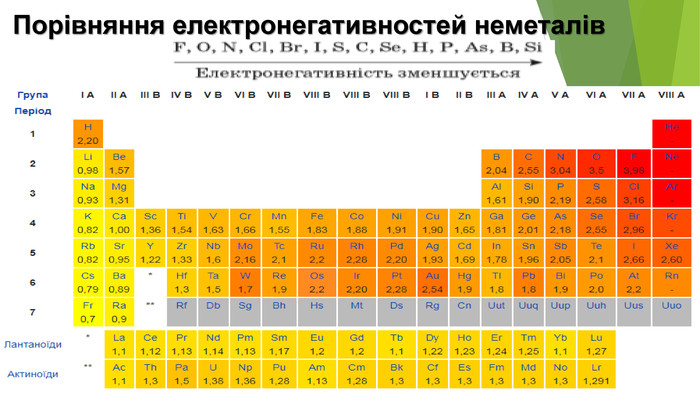
2. Будова неметалів. Частина неметалів має атомну будову. З окремих атомів складаються інертні гази — гелій, неон, аргон, криптон, ксенон і радон. У графіті, алмазі, силіції, борі, червоному фосфорі атоми сполучені один з одним.Інші неметали — молекулярні речовини. Існують неметали, які складаються із двохатомних молекул. (Назвіть ці речовини.) Більша кількість атомів міститься в молекулах озону О3, білого фосфору Р4, сірки S8. Атоми в неметалах сполучені ковалентними неполярними зв’язками — простими, іноді подвійними, потрійними.
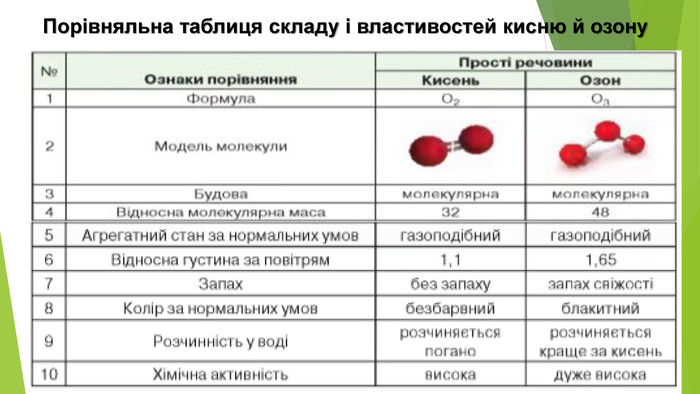
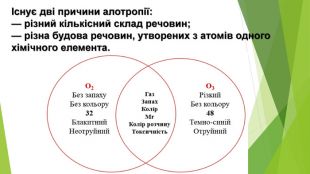
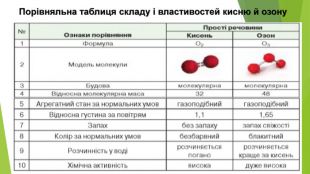
- Алотропні модифікації Оксигену Кисень: • за звичайних умов газ без кольору, смаку та запаху, рідкий кисень — рухома блідо-блакитна рідина, твердий — сині кристали; • розчинність у воді: за 0°С в 1 л води розчиняється 4,9 мл кисню, за 20°С — 3,1 мл; • густина за нормальних умов 1,43 г/л; • tпл = - 183°С, tкип = - 219°С; • парамагнітний: рідкий та твердий кисень притягуються магнітом.
- Алотропні модифікації Оксигену. Озон: • блакитний газ із різким характерним «металічним» запахом, рідкий озон має темно-синій колір, твердий — чорно-фіолетовий; • розчинність у воді: за 0°С в 1 л води розчиняється 49,4мл озону, за 25°С — 45,4 мл; • густина за нормальних умов 2,14 г/л; • tпл = - 112°С, tкип = - 197°С; • виявляє слабкі парамагнітні властивості.
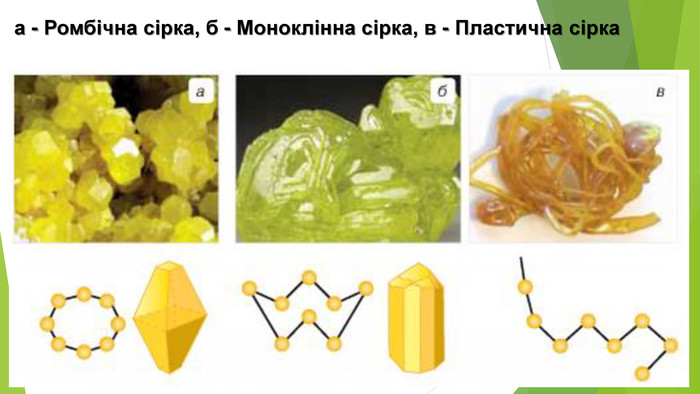
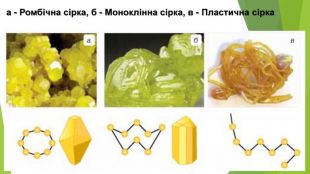
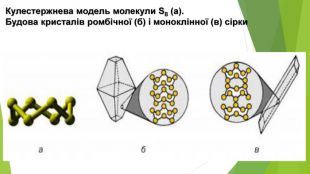
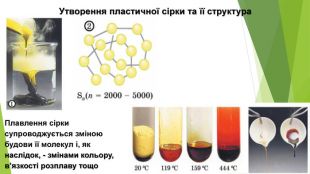
- Алотропні модифікації Сульфуру Ромбічна сірка: • світло-жовтий порошок або яскраво-жовті кристали з молекулярними кристалічними ґратками; • крихка; • нерозчинна у воді, розчиняється в органічних розчинниках (етанол, хлороформ, бензен тощо); • густина 2,07 г/см3; • tпл = 112,8°С, tкип = 444,5°С; • стабільна за температури менше 95,4°С.
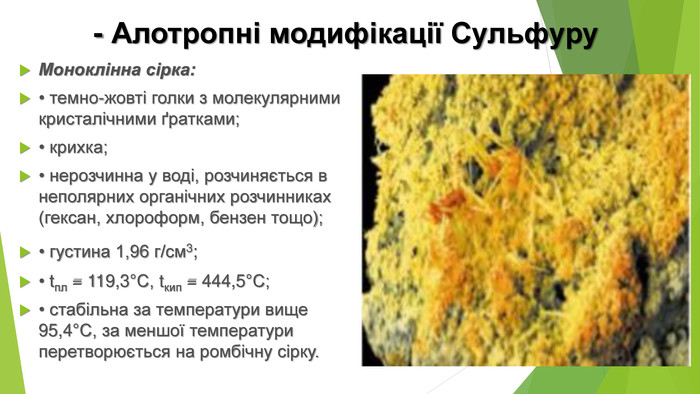
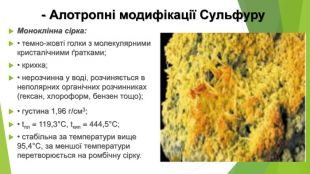
- Алотропні модифікації Сульфуру. Моноклінна сірка: • темно-жовті голки з молекулярними кристалічними ґратками; • крихка; • нерозчинна у воді, розчиняється в неполярних органічних розчинниках (гексан, хлороформ, бензен тощо); • густина 1,96 г/см3; • tпл = 119,3°С, tкип = 444,5°С; • стабільна за температури вище 95,4°С, за меншої температури перетворюється на ромбічну сірку.
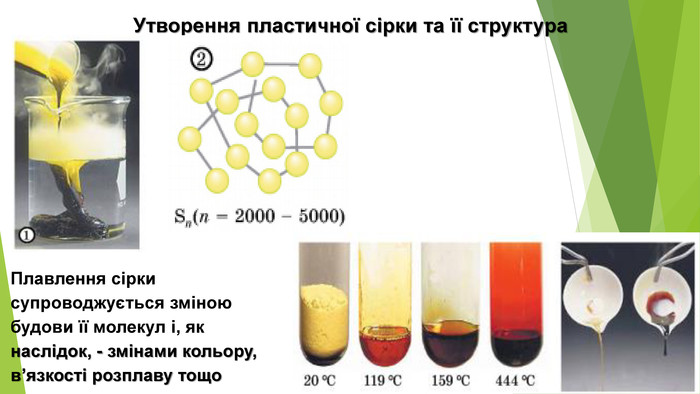
- Алотропні модифікації Сульфуру. Пластична сірка: • темно-коричнева або темно-жовта аморфна речовина; • еластична, гумоподібна; • нерозчинна; • густина 1,92 г/см3; • плавиться в діапазоні температур, tкип = 445 °С; • нестабільна, протягом кількох годин стає крихкою і перетворюється на ромбічну
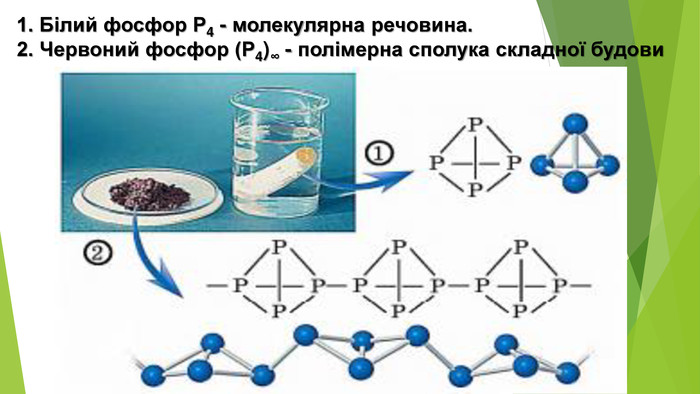
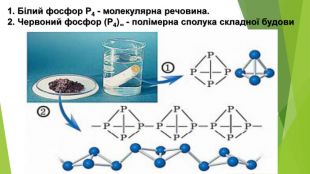
- Алотропні модифікації Фосфору. Білий фосфор Р4 • Безбарвний, воскоподібний, на світлі швидко жовтіє і втрачає прозорість; • м’який, можна розрізати ножем; • має молекулярні кристалічні ґратки з тетраедричними молекулами Р4 у вузлах; . • tпл = 44 1°С; • нерозчинний у воді, розчиняється в органічних розчинниках; • густина 1,82 г/см3; • вогненебезпечний, займається навіть від теплоти людського тіла, тому його зберігають під шаром води; • на повітрі повільно окиснюється, майже вся енергія цієї екзотермічної реакції виділяється у вигляді світла, яке видно в темряві; • отруйний, смертельна доза для дорослої людини близько 0,05-0,1 г; • утворюється з червоного фосфору під час тривалого нагрівання за температури 240-250 °С в інертній атмосфері.
- Алотропні модифікації Фосфору. Червоний фосфор (Р4) ∞ • Аморфний червоно-фіолетовий порошок залежно від ступеня подрібнення може бути від пурпурово-червоного до фіолетового кольору, тому червоний фосфор іноді називають фіолетовим; • крихкий, має атомні кристалічні ґратки; • температури плавлення не має, за температури 240-250 °С сублімує і перетворюється на випари білого фосфору; • густина 2,4 г/см3; • неотруйний; • хімічно менш активний за білий, його можна зберігати на повітрі; • під час зберігання на повітрі поступово окиснюється з утворенням гігроскопічного оксиду, поглинає воду з повітря і відволожується, тому його необхідно зберігати в герметичному посуді; • утворюється з білого фосфору під час несильного тривалого нагрівання.
- Алотропні модифікації Фосфору. Чорний фосфор Р∞• Чорна речовина з металічним блиском, жирна на дотик (схожа на графіт); • має атомні кристалічні ґратки, що складаються із шарів атомів Фосфору; • tпл = 1000 °С за тиску 18 атм.; • не розчиняється в жодному розчиннику і важко вступає в хімічні реакції; • густина 2,69 г/см3; • виявляє напівпровідникові властивості; • неотруйний; • утворюється за високого тиску (20 тис. атм.) із білого й червоного фосфору.
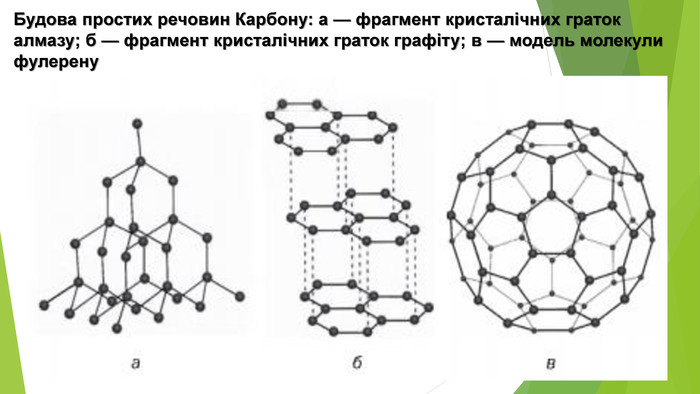
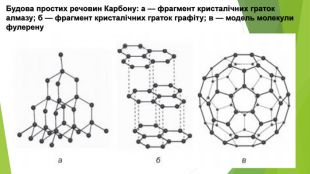
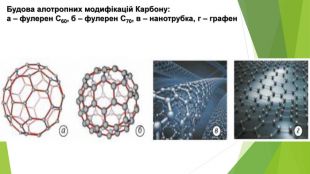
- Алотропні модифікації Карбону. Алмаз (від давньогрец. adamas — незламний) — найтвердіший природний матеріал. Він надзвичайно тугоплавкий, розплавити його вдається лише за температури близько 4000 °С і тиску понад 100 атм. Незважаючи на високу твердість, алмаз крихкий — його можна розколоти ножем. Він погано проводить теплоту, є діелектриком. Унікальні властивості алмазу зумовлені особливостями його кристалічних ґраток. Кристал алмазу являє собою єдиний каркас із атомів Карбону — саме тому він має надзвичайну твердість. Алмаз метастабільний: за звичайних умов він може існувати нескінченно довго, але за підвищеної температури поступово перетворюється на графіт.
- Алотропні модифікації Карбону. Графіт, на противагу алмазу, — це м’яка речовина, за твердістю поступається навіть паперу. Він жирний на дотик, має металічний блиск. На відміну від більшості неметалів, графіт проводить електричний струм, але не так добре, як метали. Графіт має шарувату структуру — атоми Карбону в ньому утворюють пласкі шари. Окремий шар зверху нагадує бджолині стільники. Графіт складається з окремих лусочок. Коли графітовий олівець торкається паперу, частина лусочок залишається на аркуші, утворюючи слід. Недарма слово «графіт» походить від грецького «графо», що означає «пишу». За кімнатної температури й атмосферного тиску графіт — це найстійкіша модифікація Карбону. За тиску 50 тис. атм., підвищеної температури і наявності каталізатора (нікелю) у промисловості одержують штучні алмази, які використовують у техніці. Але маса таких алмазів не перевищує 0,2 г.
- Алотропні модифікації Карбону. Карбін за фізичними властивостями схожий на графіт і іноді трапляється в ньому у вигляді білих прожилок. Карбін має лінійну будову: Карбіни — електронейтральні сполуки одновалентного атома вуглецю з вільною електронною парою та неспареним електроном. Зовнішнім виглядом карбін: чорний дрібнодисперсний порошок, має напівпровідникові властивості. Теоретичні розрахунки говорять про найбільшу термодинамічну стійкість нової форми елементарного вуглецю. Крім того, очікується, що нитковидні кристали карбіну виявляться найміцнішими матеріалами на Землі.
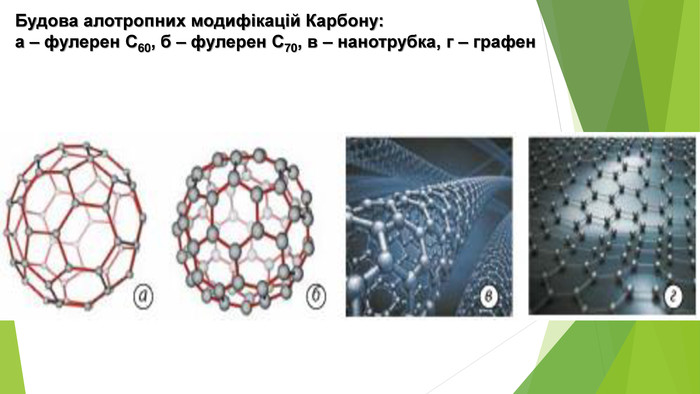
- Алотропні модифікації Карбону. Графен був відкритий в 2004 році. Графен схожий за своєю будовою на окремий атомний шар у структурі графіту. Графен можна уявити у вигляді «розгорнутої» вуглецевої нанотрубки. Цікаво! Британські вчені використали графен для побудови дрона Juno і у липні 2018 р. Завдяки новітньому матеріалу безпілотник може літати в грозу, оскільки, за словами розробників, розряди блискавки просто розпорошаться по фюзеляжу. Також перевагами є менша вага дрона і захист від намерзання.
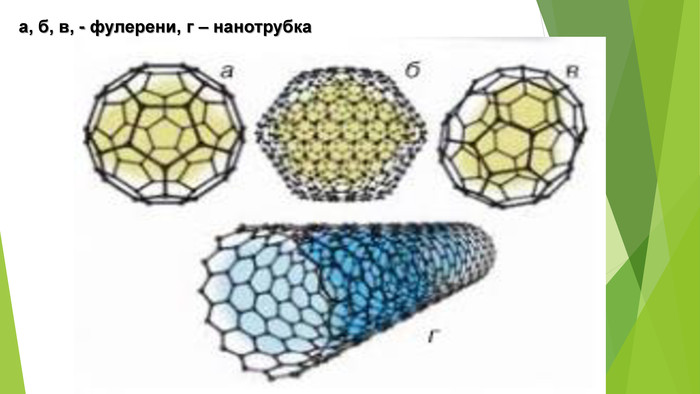
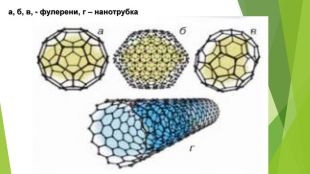
- Алотропні модифікації Карбону. Фулерени — це тверді кристалічні речовини, які, на відміну від інших алотропних модифікацій, розчиняються в органічних розчинниках з утворенням яскраво забарвлених розчинів. Молекули фулеренів являють собою сфери або еліпсоїди. Моделі молекул фулерену С60 та фулерену С70
- Алотропні модифікації Карбону. Вуглеце́ві або карбонові нанотру́бки — протяжні циліндричні структури діаметром від одного до декількох десятків нанометрів і завдовжки до декількох мікронів. Вуглецеві нанотрубки — трубчасті наноутворення вуглецю. Виявлені 1991 року. Бувають одно- і багатошарові.
1. Чим різняться між собою прості речовини: а) Оксигену; б) Карбону? 2. Охарактеризуйте хімічний зв’язок у молекулі S2 (із таких молекул складається газувата сірка за дуже високої температури). 3. Які властивості графіту зумовлюють його використання на практиці? Поясніть ці властивості речовини, виходячи з її будови. 4. Як можна пояснити те, що білий фосфор виявляє більшу хімічну активність, ніж червоний фосфор? Чи слід чекати на аналогічну відмінність в активності ромбічної та моноклінної сірки? 5. Яка кількість речовини міститься: а) в 0,48 г озону; б) в 4,48 л аргону (н. у.)? 6. Масова частка озону в суміші з киснем становить 7,2 %. Обчисліть об’ємну частку озону в цій суміші.
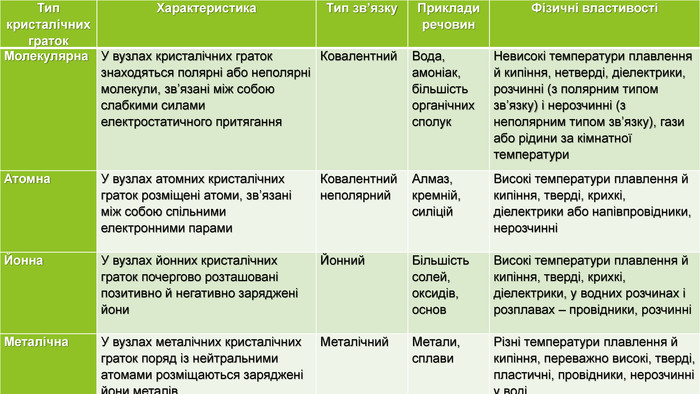
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Тип кристалічних граток. Характеристика Тип зв’язку Приклади речовин. Фізичні властивостіМолекулярна У вузлах кристалічних граток знаходяться полярні або неполярні молекули, зв’язані між собою слабкими силами електростатичного притягання Ковалентний Вода, амоніак, більшість органічних сполук. Невисокі температури плавлення й кипіння, нетверді, діелектрики, розчинні (з полярним типом зв’язку) і нерозчинні (з неполярним типом зв’язку), гази або рідини за кімнатної температури Атомна. У вузлах атомних кристалічних граток розміщені атоми, зв’язані між собою спільними електронними парами. Ковалентний неполярний. Алмаз, кремній, силіцій Високі температури плавлення й кипіння, тверді, крихкі, діелектрики або напівпровідники, нерозчинніЙонна У вузлах йонних кристалічних граток почергово розташовані позитивно й негативно заряджені йони. Йонний Більшість солей, оксидів, основ. Високі температури плавлення й кипіння, тверді, крихкі, діелектрики, у водних розчинах і розплавах – провідники, розчинніМеталічна. У вузлах металічних кристалічних граток поряд із нейтральними атомами розміщаються заряджені йони металів. Металічний Метали, сплави. Різні температури плавлення й кипіння, переважно високі, тверді, пластичні, провідники, нерозчинні у воді


про публікацію авторської розробки
Додати розробку

























-

Потапова Галина Іванівна
22.01.2025 в 00:59
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Світлична Алла Вікторівна
30.11.2023 в 20:19
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Инна
20.11.2022 в 19:33
Дякую за допомогу.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевченко Світлана Василівна
14.12.2021 в 20:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пантілімонов Святослав
08.12.2021 в 18:52
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Ковіна Ольга Юріївна
28.11.2021 в 19:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чорна Ірина Петрівна
22.11.2021 в 09:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Холодар Людмила Олександрівна
16.11.2021 в 22:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рибак Олена Миколаївна
09.11.2021 в 19:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Зубчик Віта Олександрівна
01.12.2020 в 20:41
Дуже дякую)))
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Супрун Ольга Петрівна
25.11.2020 в 09:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ростя Анна Володимирівна
06.11.2020 в 09:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ростя Анна Володимирівна
06.11.2020 в 09:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гордєєва Тетяна Валеріївна
25.10.2020 в 15:14
Дякую.
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Ковальова Вікторія
28.04.2020 в 10:23
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 12 відгуків