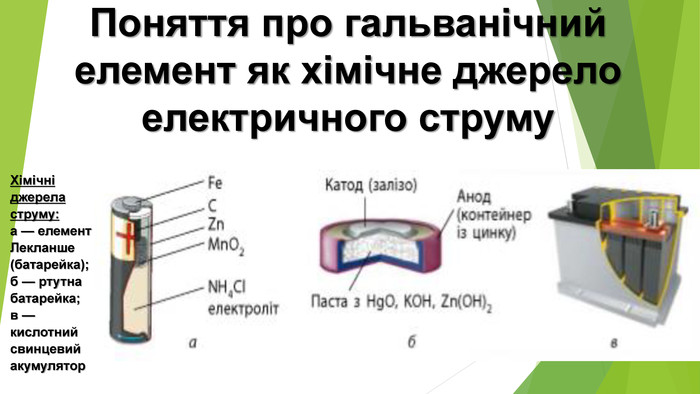
Презентація по темі: "Поняття про гальванічний елемент як хімічне джерело електричного струму."
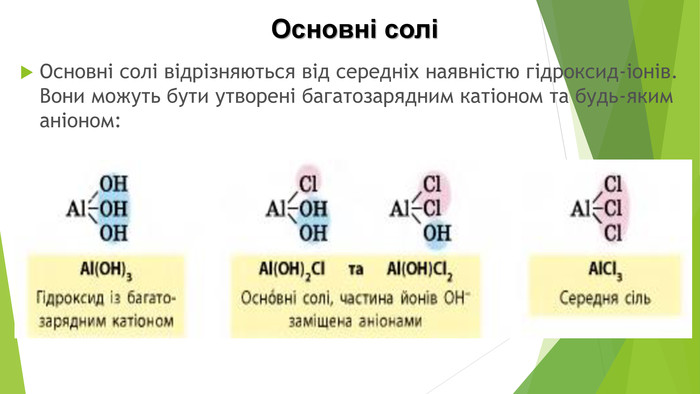
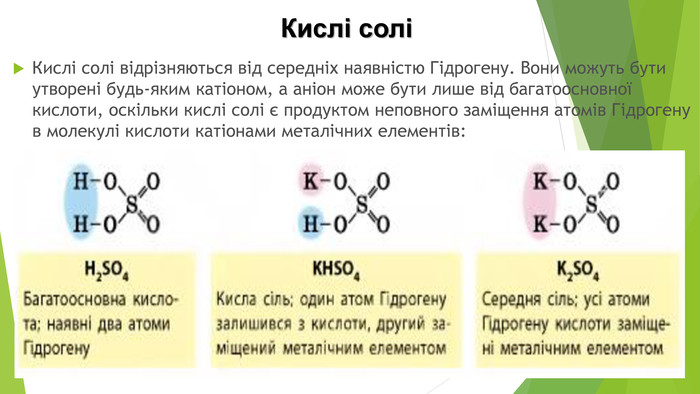
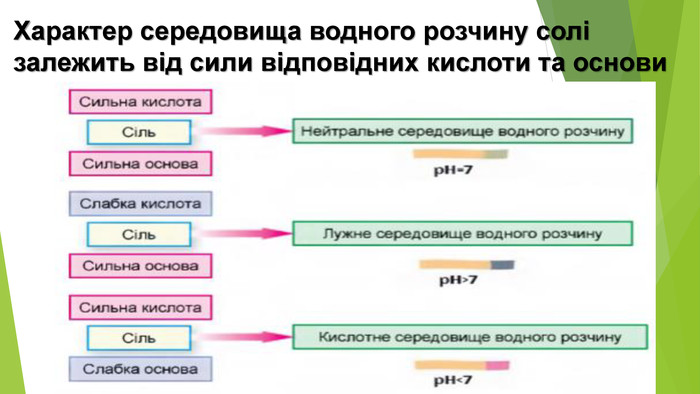













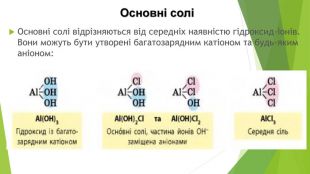
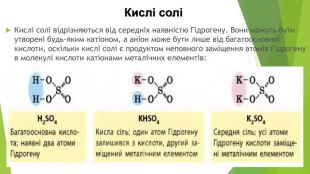
Кислі солі Кислі солі відрізняються від середніх наявністю Гідрогену. Вони можуть бути утворені будь-яким катіоном, а аніон може бути лише від багатоосновної кислоти, оскільки кислі солі є продуктом неповного заміщення атомів Гідрогену в молекулі кислоти катіонами металічних елементів:
Якщо вирощувати гортензію на ділянці, де рівень p. H ґрунту становить 6,0-6,2, то на рослині розцвітуть рожеві квіти. Якщо ж знизити p. H до 5,0-5,2, то виростуть квіти з блакитними або фіолетовими пелюстками. Ґрунт з p. H між 5,5-6,0 зумовить фіолетовий колір квітів або суміш рожевого і блакитного на одному кущі гортензії. Якщо полити нейтральний ґрунт слабким розчином ферум(ІІ) сульфату, гортензія забарвиться у фіолетовий колір
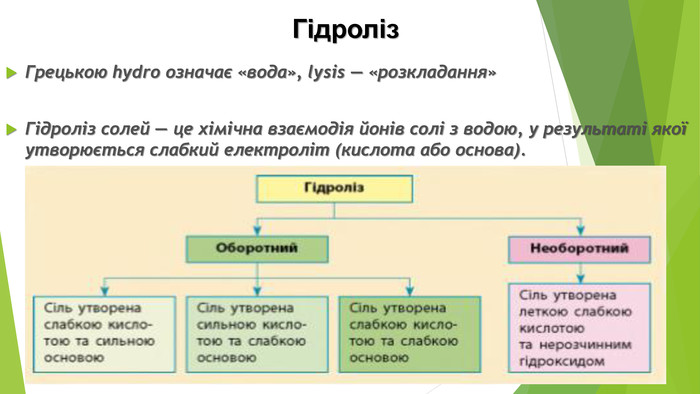
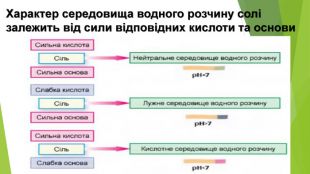
Із переліку речовин випишіть ті, що піддаються гідролізу. Складіть для них рівняння реакцій гідролізу та визначте кислотність їхніх розчинів. Якщо для солі характерний ступінчастий гідроліз, складіть рівняння гідролізу тільки за першою стадією. Na2 S04, K2 S03, Cu. S04, KBr, AICI3, Na. N02, Mn. Br2, K3 P04, Ba. CI2, Cr(N03)3, Rb. CI, Na2 Si03, KN03, Mg. CI2, CH3 COONa, Fe. CI2, Na. HC03, K2 HP04
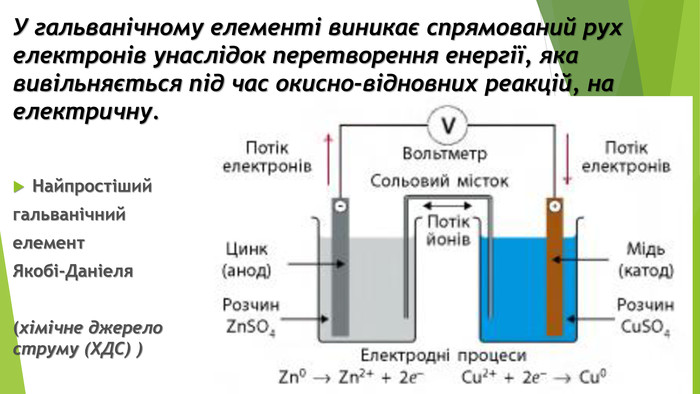
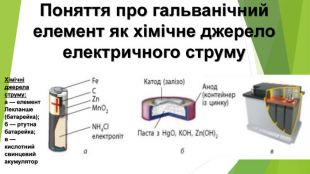
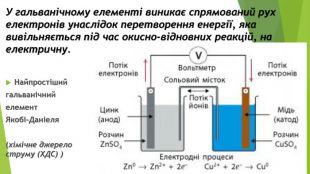
1. Поняття про гальванічний елемент 1. Луїджі (Алоїзій) Гальвані (1737-1798, Італія) - медик і фізик, засновник електрофізіології. 2. Алессандро Джузеппе Вольта (1745-1827, Італія) - фізик і фізіолог, засновник електродинаміки. Створив перше найпростіше хімічне джерело струму (1799), яке назвав на честь свого друга, Луїджі Гальвані, гальванічним елементом
2. Різновиди та характеристики гальванічних елементів Пристрої, які виробляють електричний струм унаслідок перебігу в них окисно-відновних реакцій, називають хімічними джерелами струму (ХДС)Такі елементи відрізняються значенням електрорушійної сили (ЕРС){5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Стандартний елемент Якобі-Даніеля. ЕРС у межах 0,8-2,1 ВЗвичайні електричні батарейки. ЕРС = 1,5 ВТеоретично можливо сконструювати гальванічний елемент. ЕРС майже 6,5 В
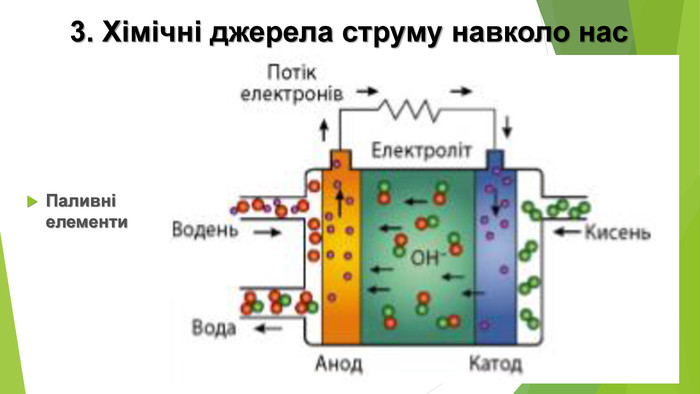
Електричні акумулятори — це також гальванічні елементи, але, завдяки особливостям конструкції та використаних матеріалів, їх можна відновлювати — регенерувати. У гальванічних елементах із часом упродовж роботи витрачаються певні речовини або відбуваються інші процеси, унаслідок яких ЕРС знижується. На відміну від одноразових елементів, акумулятори можна відновити майже до первісного стану, підключивши їх до зовнішньої електричної мережі. Під дією зовнішнього джерела струму окисно-відновна реакція всередині акумулятора перебігає у зворотному напрямку — відбувається зарядка акумулятора. Свинцевий акумулятор – ЕРС = 2 В
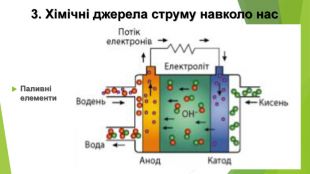
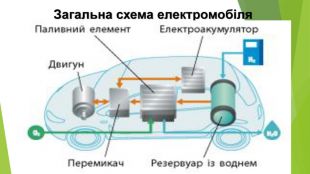
Айса Міжено та її винахід. SALt (Sustainable Alternative Lighting) - лампа, яка може горіти протягом 8 годин на одній склянці води і двох чайних ложках солі. Волонтер Грінпіс і за сумісництвом інженерка університету De La Salle Айса Міжено (Aisa Mijeno) прийшла до ідеї створення «соляного світильника» під час перебування в місцевих філіппінських племенах. Це світлодіодна лампа, джерелом енергії для якої є гальванічний елемент. За словами винахідниці, готовий продукт - сольова батарея - не тільки забезпечить світлом будинки без центральної електромережі, а й дасть змогу заряджати мобільні пристрої (смартфони, планшети) через USB-порт, убудований у бічну частину лампи.
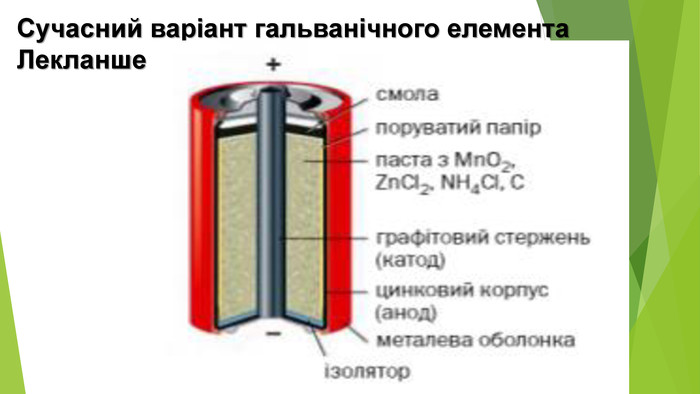
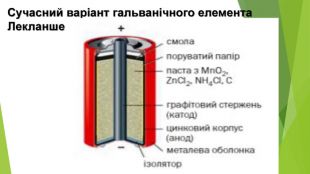
Гальванічні елементи — набагато економічніші й ефективніші пристрої для перетворення енергії хімічних зв'язків на корисну роботу1. Визначте, яким може бути склад гальванічного елемента (матеріал електродів та склад електролітів), у якому відбуваються процеси: на аноді: Ni° +20 Н- - 2е- —» Ni(OH)2; на катоді: Ni(OH)3 + е- -> Ni(OH)2 + ОН-. Складіть сумарне молекулярне рівняння хімічної реакції в цьому елементі. 2. Корозія металів — це поширений, але шкідливий і небажаний процес, що іноді може спричинити значні неприємні наслідки. Корозія заліза відбувається за реакцією: 4 Fe + 302 + 6 Н20 = 4 Fe(OH)3. Як ви вважаєте, чи можна корозію кузова автівки використати з користю, наприклад, для генерації електроенергії?3. Початкові маси мідної та цинкової пластинок в елементі Деніела становили по 20 г. Під час роботи елемента маса мідної пластинки збільшилася на 12,8 %. Якою стала маса цинкової пластинки? 4. В елементі Лекланше маса цинку зменшилася на 0,26 г. Яка маса манган(І\/) оксиду зазнала хімічного перетворення?
Міні-проект: Лимонний гальванічний елемент. Обережно почавіть лимон, щоб не здерти шкірку, та зробіть два невеликі розрізи на його протилежних боках. У розрізи вставте цинкову та свинцеву пластинки, з'єднайте їх із вольтметром і визначте показники (мал. а). Повторіть дослід, використовуючи інші наявні металеві пластини (стрижні або фольгу) в різних комбінаціях. Поясніть отримані результати. Для точніших вимірювань замість одного лимона можна використати низку послідовно з'єднаних лимонних гальванічних елементів (мал. б). Замість лимона можна використати апельсин або інший фрукт. Дослідіть, чи залежать показники вольтметра від використаного фрукта. Пам'ятайте! Після дослідів використані фрукти їсти не можна!


про публікацію авторської розробки
Додати розробку















-

Danchenko Yuliya Mykhailivna
06.12.2021 в 18:15
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Гура Ірина Сергіївна
05.11.2021 в 07:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Світлана Гапішко
15.12.2020 в 04:28
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крюкова Ірина Валеріївна
28.03.2020 в 13:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Отрощенко Юлія Володимирівна
11.03.2020 в 13:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Куделя Григорий Павлович
08.02.2020 в 16:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука