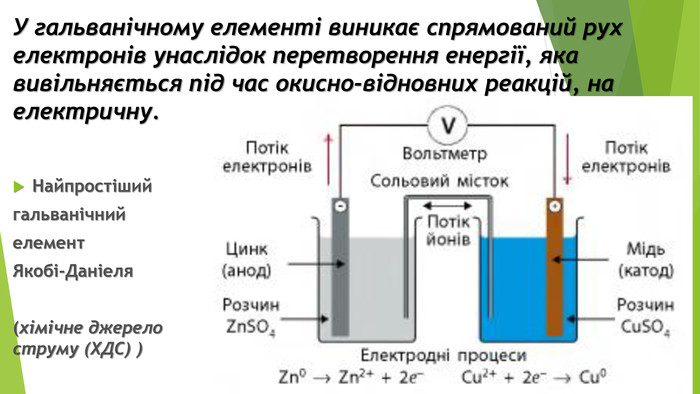
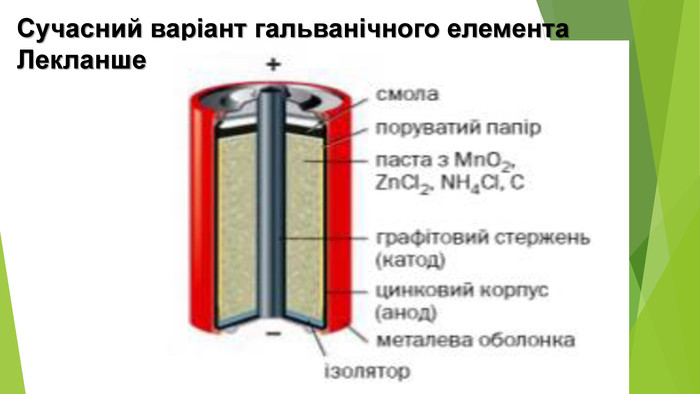
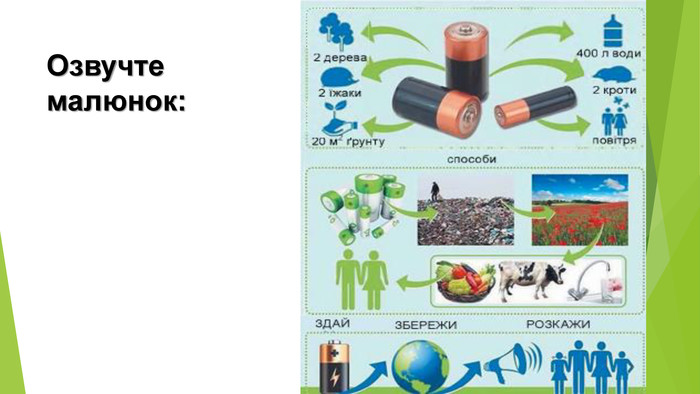
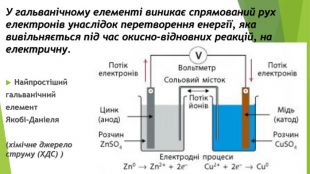
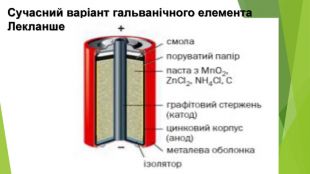
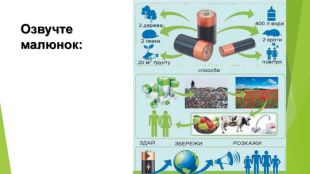
Презентація по темі: "Відносний вихід продукту реакції. Розв'язування задач" 2 год.
Про матеріал
Презентація по темі: "Відносний вихід продукту реакції. Розв'язування задач" 2 год. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку