Розробка уроку з хімії в 11 класі по темі: "Розв'язування задач на відносний вихід продукту". 2 год.
1. Обчислення за хімічними рівняннями відносного виходу продукту реакції.
Предметні компетентності:
учні обчислюють за хімічними рівняннями відносний вихід продукту реакції, обґрунтовуючи обраний спосіб розв’язання.
Ключові компетентності:
спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, екологічна грамотність і здорове життя, уміння вчитися упродовж усього життя.
Хід уроку:
І. Актуалізація опорних знань:
- гальванічний елемент;
- захист навколишнього середовища
ІІ. Вивчення нового матеріалу:
1. Відносний вихід продукту реакції
Під час хімічних процесів на великих хімічних підприємствах трапляються втрати цільового продукту. Часто це пов’язано з тим, що певну хімічну взаємодію неможливо здійснити до кінця. Отже, продукту реакції реально отримують менше, ніж мали отримати за розрахунками за масами реагентів, які помістили в реактор. Ці втрати характеризують відносний вихід продукту реакції — ɳ (грецька буква «ета»), який часто називають просто «вихід продукту». Відносний вихід продукту реакції обчислюють як відношення маси продукту реакції, яку реально отримано (її частіше називають «практична маса» і позначають mпракт), до маси продукту реакції, яку мали отримати з наявних у реакторі реагентів («теоретична маса», mтеор):
![]()
Для обчислення відносного виходу замість маси продукту реакції також можна використовувати об’єм або кількість речовини:
![]()
![]()
Практичний вихід — це кількість речовини, маса або об’єм продукту реакції, одержаних практично.
Теоретичний вихід — це кількість речовини, маса або об’єм продукту реакції, обчислених за рівнянням реакції.
Відносний вихід продукту реакції (ɳ) — це відношення маси, об’єму, кількості речовини продукту реакції, одержаного практично, до його маси, об’єму, кількості речовини, обчислених за рівнянням реакції.
Зверніть увагу:
• обчислення за формулами здійснюють із величинами (маса mпракт і mтеор, об’єм Vnpaкт і Vтeop., кількість речовини nпракт i nтеор), що стосуються лише продукту реакції, але в жодному разі не реагентів;
• для обчислень за рівняннями хімічних реакцій можна використовувати лише величини, що називають теоретичними (nтеор , mтеор і Vтeop)
• в умовах задач «практичні» величини (nпракт , mпракт і Vnpaкт) легко відрізнити: про них пишуть так, нібито речовину необхідно реально одержати (або вже одержано) «на руки», тобто реально запакувати й відправити на склад;
• для обчислень зручніше використовувати відносний вихід продукту реакції в частках від одиниці, а не у відсотках, тому перед розв’язанням відсотки слід перевести в частки від одиниці (як і у випадку з масовою часткою розчиненої речовини).
2. Багатостадійні процеси
Чимало технологічних процесів є багатостадійними. Так, виробництво сульфатної кислоти складається з трьох стадій. Якщо сировиною є пірит FeS2, то відбуваються такі реакції:
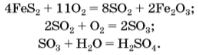
На кожній стадії одна сульфуровмісна сполука перетворюється на іншу. Перехід атомів Сульфуру від піриту до сульфатної кислоти можна проілюструвати так (враховуємо відповідні кількості речовини цього елемента):
![]()
Якщо потрібно розрахувати відносний вихід кислоти, знаючи вихідну масу піриту, то теоретичну (максимально можливу) кількість кислоти обчислюють за одну математичну дію, використавши стехіометричну схему ![]()
![]()
замість послідовного проведення розрахунків за трьома рівняннями реакцій.
3. Алгоритми обчислень

Алгоритм обчислення відносного виходу продукту реакції, якщо відомі його практичний вихід та кількість речовини (маса, об’єм) реагенту

Алгоритм обчислення практичного виходу продукту реакції, якщо відомі його відносний вихід та кількість речовини (маса, об’єм) реагенту

Алгоритм обчислення кількості (маси, об’єму) реагенту, якщо відомі кількість (маса, об’єм) продукту реакції та його відносний вихід
4. Розв’язування задач
1) Обчисліть відносний вихід сульфур(VІ) оксиду, якщо із сульфур(ІV) оксиду об’ємом 123,2 л (н. у.) одержано сульфур(VІ) оксид масою 392 г.

2) Обчисліть об’єм етину С2Н2, що можна одержати розкладанням метану СН4 об’ємом 250 л, якщо відносний вихід продукту реакції становить 75 %.

3) Обчисліть масу етанолу, що необхідно піддати дегідратації для одержання етену об’ємом 56 л (н. у.), якщо відносний вихід продукту реакції становить 80 %.

ІІІ. Узагальнення й систематизація знань:
1. Під час взаємодії азоту об'ємом 56 л (н. у.) із воднем було одержано амоніак масою 72,25 г. Обчисліть відносний вихід продукту реакції.
2. Під час взаємодії сульфур(І\/) оксиду об'ємом 40,32 л (н. у.) із киснем було одержано сульфур(УІ) оксид масою 100,8 г. Обчисліть відносний вихід продукту реакції.
3. Під час термічного розкладання метану об'ємом 78,4 л (н. у.) було одержано етин масою 36,4 г. Обчисліть відносний вихід продукту реакції.
4. Під час взаємодії амоніаку об'ємом 10,64 л (н. у.) із киснем за наявності каталізатора було одержано нітроген(ІІ) оксид масою 12,825 г. Обчисліть відносний вихід продукту реакції.
5. Під час каталітичного окиснення етанолу масою 6,9 г було одержано оцтову кислоту масою 5,4 г. Обчисліть відносний вихід продукту реакції.
6. Під час пропускання етанолу масою 92 г над нагрітим алюміній оксидом одержали етен об'ємом 42,56 л (н. у.). Обчисліть відносний вихід продукту реакції.
7. Обчисліть об'єм етену (н. у.), який можна добути з етанолу масою 13,8 г, якщо відносний вихід продукту реакції становить 80 %.
8. Обчисліть масу кальцій оксиду, що добули прожарюванням вапняку масою 400 кг, якщо відносний вихід продукту реакції становить 92 %.
9. Обчисліть об'єм чадного газу (н. у.), що утвориться під час пропускання вуглекислого газу об'ємом 112 л (н. у.) крізь розпечений кокс, якщо відносний вихід продукту реакції становить 85 %.
10. Обчисліть об'єм етану (н. у.), необхідного для добування етену об'ємом 89,6 л, якщо відносний вихід продукту реакції становить 80 %.
11. Обчисліть об'єм метану (н. у.), який необхідно піддати піролізу для добування сажі масою 126 кг, якщо відносний вихід продукту реакції становить 75 %.
12. Обчисліть об'єм водню (н. у.), необхідний для добування 425 кг амоніаку, якщо відносний вихід продукту реакції становить 40 %.
13. Із 400 г кальцій броміду за реакцією з достатньою кількістю хлору добуто 280 г брому. Обчисліть відносний вихід брому.
14. При дії на цинк масою 3,25 г достатньої кількості розчину сульфатної кислоти добули 1064 мл водню (н. у.). Який відносний вихід цього газу?
15. Унаслідок реакції в суміші 9,2 г етанолу з достатньою кількістю ета- нової кислоти утворилося 11 г естеру. Обчисліть відносний вихід естеру.
16. Під час реакції купрум(ІІ) оксиду з воднем добуто 12,8 г міді. Відносний вихід металу становив 94 %. Яку масу оксиду було взято?
17. Знайдіть масу ферум(ІІІ) гідроксиду, яку добули із 8 г ферум(ІІІ) оксиду, якщо відносний вихід гідроксиду склав 87 %? Які реакції ви здійснили б у такому експерименті?
18. Яку масу хлоридної кислоти з масовою часткою хлороводню 35 % добуто в результаті реакції 1,17 кг натрій хлориду з достатньою кількістю концентрованої сульфатної кислоти, якщо відносний вихід хлороводню становив 80 %?
19. Під час пропускання кисню через спеціальний прилад (озонатор) частина цього газу перетворилася на озон 03. Об’ємна частка озону в добутій суміші газів кисню й озону становила 8 %. Яким був відносний вихід озону?
20. Після реакції в суміші азоту з трикратним об’ємом водню і приведення добутої суміші газів до початкових умов зафіксовано зменшення об’єму на 15 %. Обчисліть відносний вихід амоніаку.
ІV. Домашнє завдання:


про публікацію авторської розробки
Додати розробку
