Урок з хімії в 11 класі "Поняття про гальванічний елемент як хімічне джерело електричного струму"
Тема уроку: Поняття про гальванічний елемент як хімічне джерело електричного струму.
Мета уроку:
- розглянути поняття про гальванічний елемент як джерело електричного струму, усвідомити роботу гальванічного елемента, навчити пояснювати окисно-відновні процеси, що відбуваються на електродах.
- розвивати логічне мислення та творчі здібності, уяву та пам’ять
- формувати в учнів здатність застосовувати отримані знання на практиці; сприяти самовихованню свідомого, відповідального ставлення до навколишнього середовища; вміння знаходити потрібну інформацію використовуючи різні джерела
Тип уроку: урок засвоєння нових знань
Методи навчання: словесні, наочні і практичні.
Наскрізні лінії: здоров’я і безпека (вплив відпрацьованих батарей на організм людини);
громадянська відповідальність (відповідальність за чистоту довкілля і його збереження);
екологічна безпека і сталий розвиток (збереження природних ресурсів, застосування альтернативних джерел електричного струму);
підприємливість і фінансова грамотність (собівартість гальванічних елементів)
Обладнання: мультимедійна дошка, навчальна презентація, зразки батарейок, саморобний овочевий гальванічний елемент, ряд напруг металів
План уроку
|
Етапи |
Час |
Прийоми та методи |
|
І Організаційний етап. Позитивна установка на урок. |
1 хв. |
Стимуляційні Фронтальна бесіда
|
|
ІІ. Актуалізація опорних знань
|
7 хв. |
1.Бліц – опитування «ланцюжком». 2.Учні на дошці складають рівняння окисно-відновних реакцій |
|
III. Мотивація навчальної діяльності. |
6 хв. |
«Створення ситуації зацікавленності»- демонстрація саморобного овочевого гальванічного елемента і дискусія
|
|
IV. Вивчення нового матерiалу. |
18 хв. |
1. Історія відкриття гальванічного елемента – доповідь учня 1, доповнення доповіді учнем 2. 2. Розповідь вчителя, навчальна дискусія, демонстрація презентації; 3.Виступ учня про нобелівських лауреатів 4. Виступ учня про утилізацію батарей і акумуляторів 5. Виступ учня з доповіддю про електромобілі як альтернатива акумуляторам |
|
V. Закріплення нового матеріалу. |
6 хв |
1. Самостійна робота. Скласти за варіантами рівняння реакцій |
|
VI. Рефлексія |
3 хв |
1. «Сніжна грудка» Слово-речення –питання-відповідь 2. Відповідь на проблемне питання при мотивації 3. Підсумки |
|
VII. Дом. завдання |
2 хв |
З коментарями вчителя, запис в зошиті і в щоденнику |
|
V. Релаксацiя. |
2хв. |
Приведення аналогії, порівняння |
Хід уроку
І. Організаційний етап. Позитивна установка на урок.
Вчитель: ми продовжуємо вивчати тему «Хімічні реакції». Тема сьогоднішнього уроку дуже актуальна і цікава, я думаю, кожен з вас знайде в темі уроку користь для себе.
ІІ. Актуалізація опорних знань
1. Два учні на дошці складають окисно – відновні реакції :
Zn + CuSO4 →
Zn + AlCl3 →
2. Одночасно опитування «ланцюжком»
- Визначення процесу дисоціації
- Які речовини відносяться до електролітів?
- Що таке ряд напруг металів?
- Що означає : Al активніший за Fe?
III. Мотивація навчальної діяльності.
Вчитель: сьогодні говоримо про речі, які дуже актуальні в сучасному житті і ми вже не уявляємо , як без них обійтись. Як ви вважаєте про що піде мова? Зараз учениця покаже дослід, а ви, будь ласка, спробуйте його пояснити.
Демонстрація саморобного овочевого гальванічного елемента (лимон, картопля, цинковий і мідний електроди, вольтметр і амперметр). Як пояснити появу електричного струму в ланцюгу?
IV. Вивчення нового матерiалу.
1. Вчитель оголошує тему уроку і звертає увагу на завдання уроку для учнів. Слайди 1, 2

Доповідь учня 1 про відкриття Луїджі Гальвані, який є одним із засновників електрофізіології. Слайд 3

Доповідь учня 2. Досліди італійськкого фізика Алессандро Вольта який винайшов оригінальний пристрій, що виробляв електричний струм. Слайд 4.

2. Пояснення вчителя. Демонстрація слайдів по черзі 5, 6, 7
Перший гальванічний елемент був незручним у користуванні i мав короткий час дії: поява на електроді бульбашок газу ускладнювала рух йонів біля електроду. У 1836 році англійський хімік Джон Фредерик Даніель та незалежно від нього німецький і російський фізик-винахідник Б. С. Якобі, запропонували інший елемент, що виробляв електричний струм протягом значно довшого часу. Слайд 5
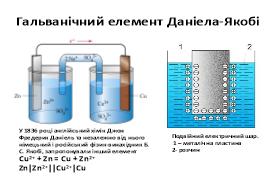 Гальванічний елемент Даніеля-Якобі складається з двох посудин . В одній міститься розчин цинк сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком), що заповнена розчином електроліту, йони якого ʜе взаємодіють з іншими йонами в гальванічному елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт між посудинами. Для того щоб розчин не виливався, кінці трубки закривають скловатою чи гелем, просоченим електролітом.
Гальванічний елемент Даніеля-Якобі складається з двох посудин . В одній міститься розчин цинк сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком), що заповнена розчином електроліту, йони якого ʜе взаємодіють з іншими йонами в гальванічному елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт між посудинами. Для того щоб розчин не виливався, кінці трубки закривають скловатою чи гелем, просоченим електролітом.
Якщо електроди з’єднати дротинками з електричною лампочкою, то вона засвітиться.
Через деякий час в обох склянках можна спостерігати хімічні перетворення: цинкова пластинка розчиняється, а на мідній пластинці з розчину осаджується мідь зменшується, а мідної збільшується. Водночас послаблюється забарвлення розчину купрум(ІІ) сульфату (концентрація йонів Сu2+ знижується). Ці хімічні зміни є результатом перенесення електронів з однієї частини елемента до іншого, тобто це типовий електрохімічний процес.
Пристрої, що виробляють електричний струм внаслідок перебігу в них хімічних реакцій, називаються хімічними джерелами струму.
Розглянемо природу цього процесу. Під дією полярних молекул води катіони металу відриваються з поверхні пластинки, гідратуються і переходять в розчин, який при цьому заряджається позитивно, а в металі накопичується надлишок електронів. Чим далі протікає процес, тим більше стає заряд як металу, так і розчину. Завдяки електростатичному притягуванню катіонів розчину і надлишкових електронів металу на межі поділу фаз виникає подвійний електричний шар .
Різниця потенціалів, що виникає між металом і розчином електроліту, називається електродним потенціалом.
Електродний потенціал залежить від природи металу.
Чим більш активний метал, тим більше його катіонів переходить в розчин і тим більш негативно заряджена поверхня металу.
Цинк активніший за мідь, тому цинкова пластинка заряджена більш негативно, ніж мідна. При з’єднанні цинкової пластинки з мідною металевим провідником електрони переходять від пластинки цинку до міді, на поверхні якої ці електрони з’єднуються з катіонами Купруму з розчину і осаджується мідь:
Сu2+ + 2ē = Сu.
Відбувається процес відновлення.
нший електрод гальванічного елемента – цинковий – розчиняється. Атоми Цинку втрачають електрони, залишаючи їx на електроді, зазнають окиснення й перетворюються на катіони:
Zn – 2ē = Zn2+.
Цинковий електрод в гальванічному елементі виступає як анод, він має негативний заряд. (При електролізі анод заряджений позитивно.)
Сумарне рівняння (окисно-відновного перетворення в гальванічному елементі:
Cu2+ + Zn = Сu + Zn2+.
Гальванічний елемент можна зобразити схематично:
Zn|Zn2+||Cu2+|Cu
Суть перетворення така сама, що й звичайної хімічної реакції:
CuSО4 + Zn = Сu + ZnSО4.
Використовувати елемент Даніеля-Якобі для живлення ліхтарика, плеєра чи калькулятора незручно. Вже давно винайдено сухі гальванічні елементи. В їхніх герметичних оболонках містяться не розчини, а пастоподібні (вологі) суміші речовин.
Найпоширеніший серед гальванічних елементів цього типу – манган-цинковий елемент, який винайшов французький хімік Ж. Лекланше ще у 1865 році.
Слайд 6
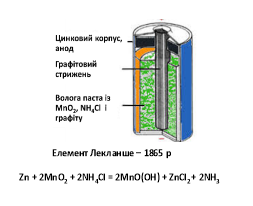
Корпус цього елемента зроблено iз цинку; він виконує роль анода (це – негативний полюс джерела струму). Всередині метиться волога паста з манган(ІV) оксиду (МпО2), амоній хлориду (NH4Cl) i графітового порошку. В пасту занурений графітовий стрижень, що виступає катодом (позитивний полюс). Елемент герметизовано смолою або воском. Під час роботи елемента відбуваються такі процеси. Цинк зазнає окиснення:
Zn − 2ē = Zn2+.
Через це корпус елемента iз середини поступово руйнується. На графітовому катоді відновлюється Манган:
Мn+4 + ē =Мn+3.
Протікає хімічна реакція, що описується рівнянням
Zn + 2MnO2 + 2NH4Cl = 2MnO(OH) + ZnCl2 + 2NH3
Існують хімічні джерела струму, які періодично заряджають від електричної мережі й використовують знову. Це акумулятори. Вони є в мобільних телефонах, ноутбуках, фотоапаратах, автомобілях.
Найпоширенішими є свинцеві, або кислотні, акумулятори . Їх робота ґрунтується на оборотній реакції.
Слайд 7

3. Виступ учня: доповідь про нобелівських лауреатів в галузі хімії в 2019 році. Нагороду вони отримали за вклад у розробку літій-іонних акумуляторів.
Слайд 8

4. Виступ учня про утилізацію батарей і акумуляторів.
У зв’язку з інтенсивним застосуванням хімічних джерел струму набула актуальності проблема їх утилізації. В багатьох країнах, у тому числі в Україні, використані батарейки збирають; контейнери для них розміщують у супермаркетах, закладах освіти .
Слайд 9

V. Закріплення нового матеріалу.
Слайд 10. Ці рівняння показують які процеси відбуваються в батареї Лекланше та в кислотному акумуляторі

1. «Сніжна грудка» Слайд 11.

2. Як же пояснити появу електричного струму в приладі учениці N? (овочевий гальванічний елемент)
3. Підсумки
VI. Рефлексія
VII. Слайд 12



про публікацію авторської розробки
Додати розробку
