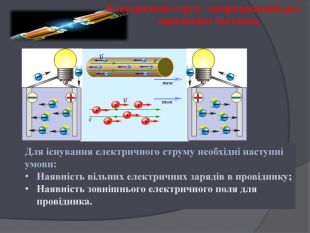
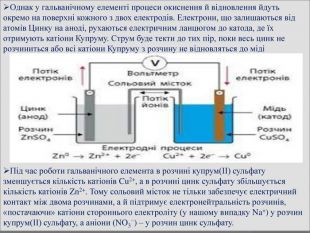
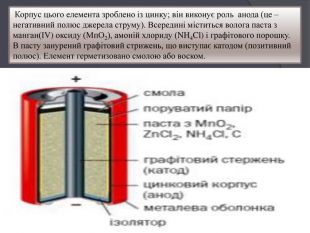
Презентація " Поняття про гальванічний елемент як хімічне джерело електричного струму"
Про матеріал
Презентацію можна використати на уроці хімії в 11 класі (рівень стандарту). Дана розробка допоможе здобувачам освіти розширити та поглибити знання про гальванічний елемент, як хімічне джерело електричного струму; систематизувати та узагальнити знання щодо протікання струму в різних середовищах; показати практичну значущість набутих знань у побуті, техніці, на виробництві.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую за розробку!
-

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку