Урок: "Алюміній, поширення в природі, фізичні та хімічні властивості."
Тема: Алюміній, поширення в природі, фізичні та хімічні властивості.
Мета: навчальна. На основі розміщення хімічних металів у періодичній системі, дати характеристику Алюмінію. На цьому підґрунті скласти уявлення про фізичні та хімічні властивості металічного алюмінію. Розглянути поширення у природі та галузі застосування. Дати учням поняття про промисловий спосіб добування алюмінію.
розвиваюча. Розвивати вміння і навчити застосовувати свої знання, формувати навички роботи в команді, розвивати здатності приймати рішення, розв’язувати проблеми.
виховна: виховувати вміння спілкуватися та бережливе ставлення до свого організму.
Тип уроку: дослідження, засвоєння нових знань.
Форма роботи: робота в малих групах.
Метод: урок – проєкт.
Обладнання: електронний посібник «Програмно – методичний комплекс», «Таблиця Менделєєва», колекція природних сполук алюмінію, штатив з пробірками, пробіркотримачі.
Речовини: алюміній, сульфатна кислота, натрій гідроксид.
Хід уроку:
1. Організація класу /формування груп/, оптимальна група 4 – 5 учасників. Організація роботи в групах: групи отримують різні завдання, працюють на загальний результат.
2. Мотивація пізнавальної діяльності.
Мета цього етапу – сфокусувати увагу учнів на проблемі й викликати інтерес до обговорюваної теми. Мотивація чітко пов’язана з темою уроку, вона психологічно готує учнів до її сприйняття, налаштовує на розв’язання певних проблем. Для успішної роботи клас поділяється на чотири групи:
1 група – проект « Al – елемент під №13»
2 група – проект « Добування і фізичні властивості алюмінію».
3 група – проект «Хімічні властивості алюмінію».
4 група – проект «Застосування алюмінію».
3. Виконання проектів.
Проводиться науково – пошукова та дослідницька робота.
(термін виконання та подання звітів обговорювався попередньо).
4. Захист проектів.
1група:
Відгадайте загадку:
Я сріблястий, я крилатий,
Високо люблю літати.
А корозії не знаю,
Плівкою себе вкриваю.
На опорах через ліс
То дротами я повис.
Можу двері змайструвати,
Посудом на кухні стати.
А народжуюсь із глини.
Чи мене назвеш ти нині? (Алюміній)
З допомогою електронного посібника учні розкривають питання:
- місце Al в періодичній системі ;
- фізичний зміст порядкового номера ;
- електронна будова атома ;
- висновок про активність елемента ;
- природні сполуки, що містять Алюміній.
Учні розглядають колекцію корисних копалин, роблять висновок, що алюміній трапляється в природі лише в складі хімічних сполук. Відомо 250 мінералів, які містять алюміній.
Алюмосилікати:
польовий шпат – K2O∙AL2O3∙6SiO2
слюда – K2O∙3AL2O3∙6SiO2∙2H2O
біла глина, або каолін – AL2O3∙2SiO2∙2H2O
корунд − AL2O3
боксит − AL2O3∙nH2O
нефелін − (Na,K)2O∙AL2O3∙2SiO2.
З бокситів і нефеліну добувають алюміній оксид., який є сировиною для одержання алюмінію.
2 група:
З допомогою електронного посібника учні розкривають питання:
- фізичні властивості алюмінію.
Алюміній – сріблясто-білий метал, досить твердий. Його густина становить 2700кг/м3, температура плавлення 660,10С. Він дуже пластичний, добре кується та витягується в дріт, добре проводить теплоту та електричний струм.
- методи добування алюмінію – електроліз.
Алюміній одержують електротермічним способом. Електролітом є алюміній оксид, розчинений у розплавленому кріоліті (Na3ALF6). До цього розплаву додають трохи алюміній фториду. Такий електроліт добре проводить електричний струм, металічний алюміній у ньому розчиняється мало. Електроліз відбувається за температури близько 9500С. Через розплав пропускають постійний струм напругою 5-8 В, силою до 100 000 А. На катоді виділяється алюміній:
AL3++3 ē → AL↓
А на аноді – кисень, який взаємодіє з вуглецем аноду:
2O2- - 4ē→O2↑; C+O2=CO2↑.
Оскільки внаслідок цього анод згоряє, його періодично нарощують.
Для виплавки алюмінію потрібно багато електроенергії: на одержання 1т алюмінію витрачається близько 20 000 кВт ∙ год.
Пам’ятка: алюміній не можна одержувати електролізом водного розчину солей.
3 група:
Учні проводять лабораторний дослід.
На основі практичних і теоретичних досліджень учні роблять висновок про хімічні властивості Алюмінію.
2AL+3H2SO4=AL2(SO4)3+3H2↑
2AL+6NaOH+6H2O=2Na3[AL(OH)6]+3H2↑
Учні аналізують опорний конспект, над яким пізніше будуть працювати усі групи.
4 група:

![]() Водний і наземний Електротехніка, побут
Водний і наземний Електротехніка, побут
транспорт
![]()
![]()
![]()
![]()
![]() у будівництві авіаційна і космічна техніка
у будівництві авіаційна і космічна техніка
фарба
пакувальна тара
Діти аналізують кожну галузь застосування .
Алюміній та його сплави широко застосовуються у народному господарстві завдяки легкості та стійкості щодо повітря та води. Наприклад, дюралюміній, що містить 95% AL,4% Cu, 0,5% Mg і 0,5% Mn, має міцність сталі, але легший за неї у три рази.
У вигляді різних сплавів алюміній використовують у авіації, суднобудуванні, на залізничному транспорті, у будівництві, приладобудуванні. З алюмінію виготовляють електричні проводи (хоч він має меншу електропровідність ніж мідь, проте значно легший та дешевший), терміт, освітлювальні ракети, кухонний посуд. Його застосовують для одержання металів і неметалів. З порошку алюмінію роблять фарбу, яка захищає залізо від корозії.
Алюмінієву фольгу використовують як обгортковий матеріал у харчовій промисловості, а також для виготовлення конденсаторів. Широко використовують також і сполуки алюмінію.
Поради:
- Алюмінієвий посуд тільки для приготування їжі. Не можна тримати в ньому квашеної капусти, маринадів, борщів, томатів, киселів. Aлюміній окислюється і продукти втрачають смак, запах, колір. Крем, чи бісквіт у такому посуді набуває сіруватого відтінку й металевого присмаку.
- Потьмяніла з середини каструля посвітлішає, коли прокип’ятити в ній воду з оцтом.
5. Робота груп з опорним конспектом.
Алюміній.
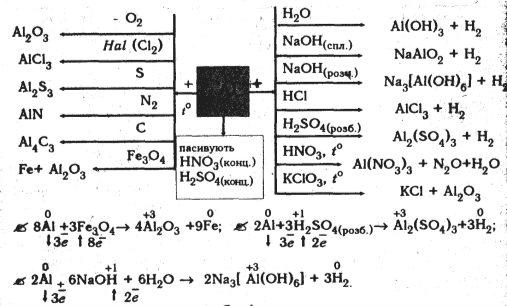
Учні за допомогою вчителя записують відповідні рівняння реакції.
6. Закріплення.
Учні в групах працюють за схемами. По закінченню проводимо взаємоперевірку з допомогою консультантів та вчителя.
![]()
![]()
![]() 1 група: Al Al2 O3
1 група: Al Al2 O3
Al2 S3
![]()
![]()
![]() 2 група: AlN Al Na Al O2
2 група: AlN Al Na Al O2
Al2 O3
![]() 3 група: Al Al2(SO4)3
3 група: Al Al2(SO4)3
![]()
![]() Al(OH)3 Al2 O3
Al(OH)3 Al2 O3
![]()
![]() 4 група: AlCl3 Al Al(NO3)3
4 група: AlCl3 Al Al(NO3)3
![]()
Al4C3
Хвилинка – цікавинка.
Чи знаєте ви, що ….
- два тисячоліття тому римському імператору Тіберію невідомий подарив дуже легку вазу, виготовлену з металу, схожого на срібло. Майстер розповів, що цей метал він добув з глинистої землі. Тиберій злякався, що новий метал знецінить золото та срібло і наказав відтяти голову майстрові, а його лабораторію знищити, щоб ніхто не дізнався про спосіб добування нового металу.
- до ХХ ст. алюміній був дуже дорогим металом.
- на початку ХХ ст. один монарх мав парадне вбрання з алюмінієвими ґудзиками.
- Наполеон 111 користувався алюмінієвим посудом, коли влаштовував прийоми для найдорожчих гостей.
- Д.І. Менделєєв подарували дуже дорогі терези, шальки у них були золотими, а все інше алюмінієвим.
7. Домашнє завдання: опрацювати параграф, підготувати презентації на теми: 1.Сполуки алюмінію в природі.
2. Застосування сполук алюмінію.
1


про публікацію авторської розробки
Додати розробку
