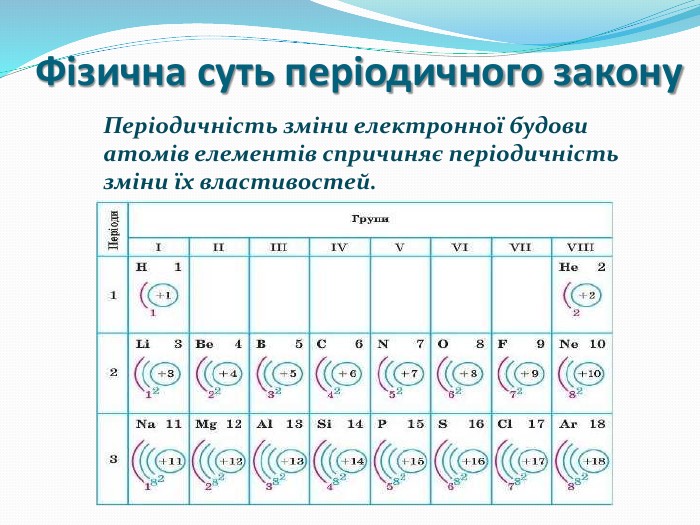
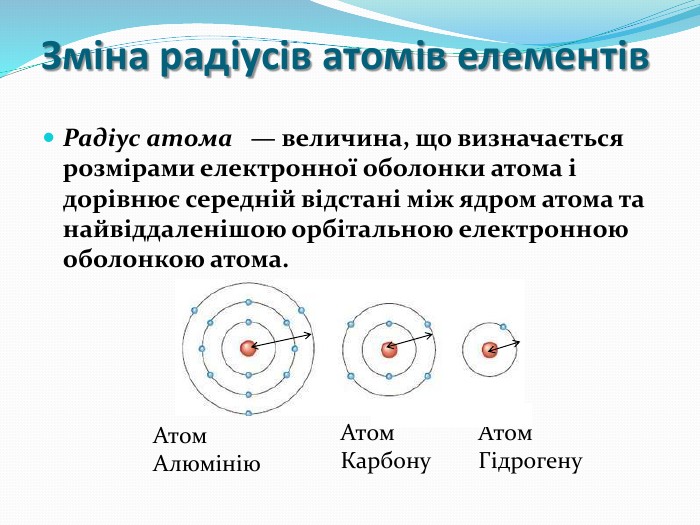
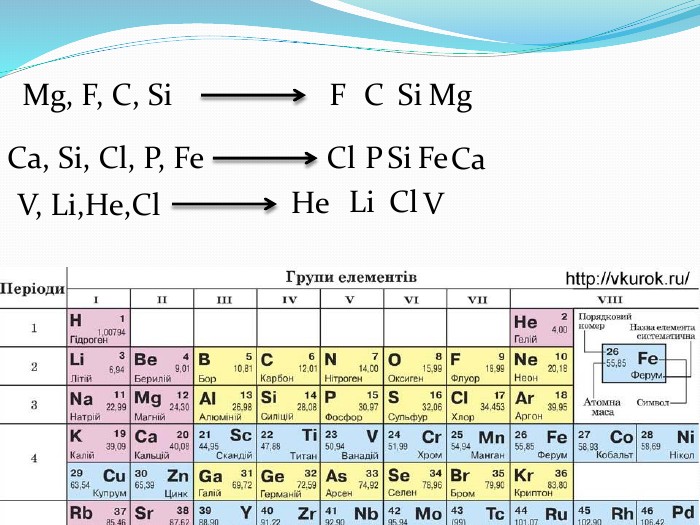
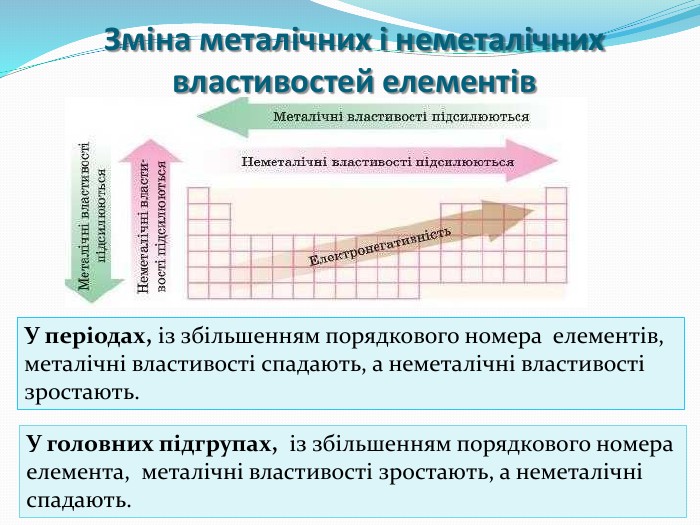
Презентація "Поняття про радіус атома"
Про матеріал
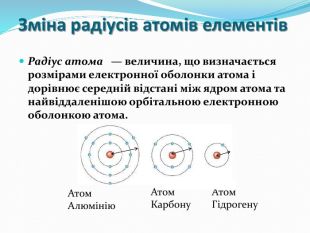
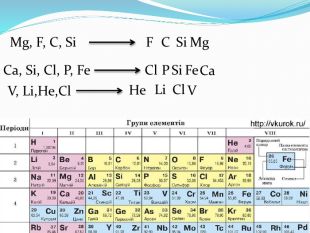
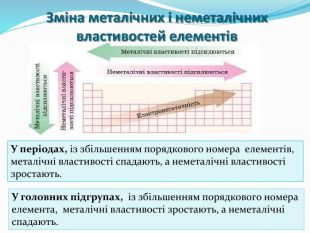
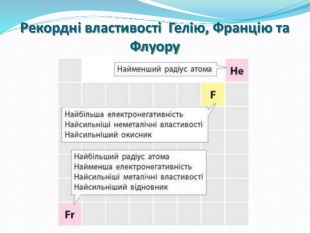
Розробка містить вправи та роз'яснення матеріалу "Радіус атома". Та різні приклади вправ зі складання електронних та електронно-графічних формул атомів Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Дякую за якісну розробку!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


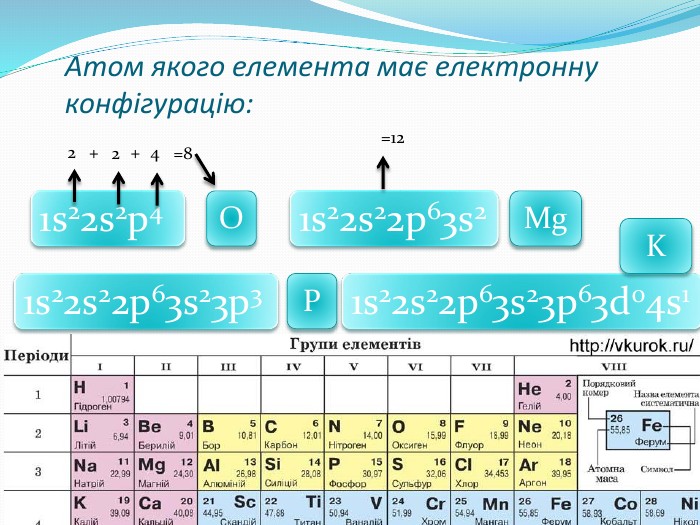
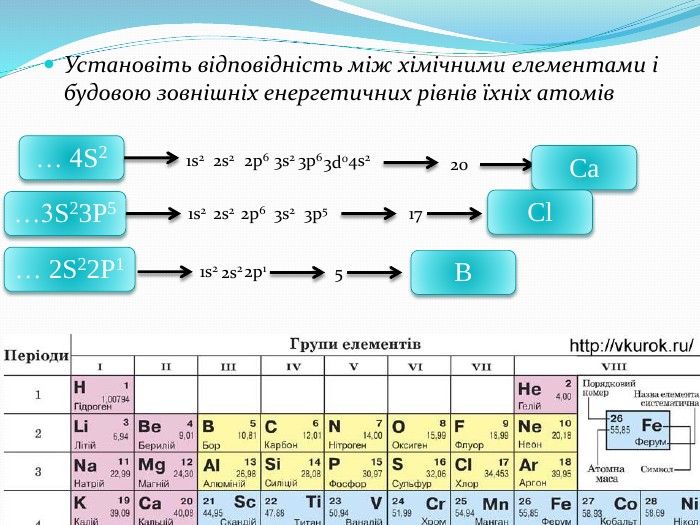
![Скорочені електронні формули атомів. S1s22s22p63s23p4[Ne] 3s23p4 O1s22s22p4[He] 2s22p4 Mn1s22s22p63s23p63d54s2[Ar] 3d54s2 Ca1s22s22p63s23p63d04s2[Ar] 3d04s2 Скорочені електронні формули атомів. S1s22s22p63s23p4[Ne] 3s23p4 O1s22s22p4[He] 2s22p4 Mn1s22s22p63s23p63d54s2[Ar] 3d54s2 Ca1s22s22p63s23p63d04s2[Ar] 3d04s2](/uploads/files/328382/307228/333982_images/4.jpg)