РЕФЕРАТ на тему: Вуглець
РЕФЕРАТ
на тему:
Вуглець
План
- Вступ. Поширення в природі……………………...3
- Біологічний колообіг Карбону………………….…4
3. Фізичні й хімічні властивості……………………..5
4. Народногосподарське значення……………….….7
5. Карбон в організмі…………………………….…...7
6. Висновки……………………………………………9
7. Використана література……………………………11
ВСТУП. ПОШИРЕННЯ В ПРИРОДІ
Карбон (лат. Carboneum, C) — хімічний елемент IV групи періодичної системи Менделєєва. Відомі два стабільні ізотопи І2С (98,892 %) і ІЗС (1,108 %).
Вуглець відомий із глибокої давнини. Деревне вугілля служило для відновлення металів із руд, алмаз — як дорогоцінний камінь. Значно пізніше почав застосовуватися графіт для виготовлення тиглів та олівців.
У 1778 p. K. Шеєле, нагріваючи графіт із селітрою, виявив, що при цьому, як і при нагріванні вугілля із селітрою, виділяється вуглекислий газ. Хімічний склад алмаза був встановлений у результаті дослідів А. Лавуазьє (1772) із вивчення горіння алмаза на повітрі й у результаті досліджень С. Теннанта (1797), який довів, що однакові кількості алмаза й вугілля дають при окисненні рівні кількості вуглекислого газу. Карбон як хімічний елемент був визнаний тільки в 1789 р. А. Лавуазьє. Латинську назву carboneim Карбон отримав від carbo — вугілля.
Середній вміст Карбону в земній корі складає 2,3 • 10-2 % за масою. Карбон накопичується у верхній частині земної кори (біосфері): у живій речовині 18 % Карбону, у деревині — 50 %, у кам'яному вугіллі — 80 %, у нафті — 85 % в антрациті — 96 %. Значна частина Карбону літосфери зосереджена у вапняках і доломітах.
Число власних мінералів Карбону — 112, винятково велике число органічних сполук Карбону — вуглеводні й їхні похідні.
З накопиченням Карбону в земній корі пов'язані нагромадження і багатьох інших елементів, що сорбуються органічною речовиною й осаджуються у вигляді нерозчинних карбонатів і т. ін.
У порівнянні із середнім умістом Карбону в земній корі, людство у винятково великих кількостях видобуває Карбон із надр (вугілля, нафта, природний газ), тому що ці копалини — основні сучасні джерела енергії.
Карбон широко розповсюджений також у космосі; на Сонці він займає четверте місце після Гідрогену, Гелію й Кисню.
БІОЛОГІЧНИЙ КОЛООБІГ КАРБОНУ
Міграція вуглекислого газу в біосфері Землі протікає двома шляхами. Перший шлях полягає у поглинанні його в процесі фотосинтезу з утворенням органічних речовин і в подальшому "похованні" їх у літосфері у вигляді торфу, вугілля, нафти, горючих сланців, осадових гірських порід. Другим шляхом міграція вуглекислого газу здійснюється при розчиненні їх у водах Світового океану, де СО2 переходить в Н2СО3, НСО3-, СО32-, а потім біогенним (зоо-чи фітогенні) або хемогенних шляхом з'єднується з кальцієм, утворюючи величезні маси СаСО3 (вапняні кістяки деяких безхребетних, вапняні водорості і вапняні мули), в результаті чого виникають потужні товщі карбонатних порід. Згідно з розрахунками вченого А. Б. Ронова, ставлення похованого вуглецю в продуктах фотосинтезу до вуглецю в карбонатних породах становить приблизно 1:4.
Крім СО2 в атмосфері присутні в невеликих кількостях ще два вуглецевих з'єднання: оксид вуглецю (II) - СО і метан СН4. Як і СО2, ці з'єднання перебувають у швидкому кругообігу.
Необхідно звернути увагу на той факт, що в умовах незайманого господарською діяльністю людини природного середовища глобальний кругообіг вуглецю та інших елементів (сірки, фосфору, азоту) є практично замкнутим. В даний час замкнутість кругообігу вуглецю знизилася приблизно на один порядок (тобто зменшилася приблизно в 10 разів), що при збереженні такої тенденції може призвести до глобальної екологічної проблеми. Таким чином, особливо важливе значення в даний час набуває наукова (експериментальна) оцінка замкнутості глобальних кругообігів основних біогенних елементів.
Вуглець гідросфери найтіснішим чином пов'язані з вуглецем атмосфери і також бере участь в життєвому циклі, як і останній (фотосинтез здійснюється і водними рослинами, а виділення двоокису вуглецю в воду відбувається також при диханні гетеротрофів в океані). Таким чином, життєвий цикл охоплює живу речовину суходолу та моря, вуглекислий газ в атмосфері і розчинену вуглекислоту морської води і здійснюється через фотосинтез, дихання гетеротрофів і газообмін між атмосферою і гідросферою.
ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ
Відомі чотири кристалічні модифікації вуглецю: графіт, алмаз, карбін і лонсдейліт.
Графіт — сіро-чорна, непрозора, жирна на дотик, дуже м'яка маса з металевим блиском.
Алмаз — дуже тверда кристалічна речовина. Кристали мають кубічну гра-нецентровану решітку (А = 3,560Е). Помітне перетворення алмаза на графіт спостерігається при температурах понад 1 400 °С у вакуумі або в інертній атмосфері. При атмосферному тиску й температурі близько 3 700 °С графіт випаровується.
Рідкий вуглець можна отримати при тиску вищому за 103 МПа, і температурах вищих за 3 700 °С. Для твердого вуглецю (кокс, сажа, деревне вугілля) характерним є також стан із неупорядкованою структурою — «аморфний» вуглець, який не являє собою самостійної модифікації; в основі його будови лежить структура дрібнокристалічного графіту. Нагрівання деяких різновидів «аморфного» вуглецю вище за 1 500—1 600 °С без доступу повітря викликає їхнє перетворення на графіт. Фізичні властивості «аморфного» вуглецю дуже сильно залежать від дисперсності частинок і наявності домішок. Густина, теплоємність, теплопровідність і електропровідність «аморфного» вуглецю завжди вища, ніж графіту.
Карбін отриманий штучно. Він являє собою дрібнокристалічний порошок чорного кольору (густина р (4 °С) = 1,9—2 г/см3). Побудований з довгих ланцюжків атомів Карбону, покладених паралельно один до одного.
Лонсдейліт знайдений у метеоритах і отриманий штучно; його структура й властивості остаточно не встановлені.
Електронна конфігурація зовнішньої оболонки атому Карбону 2s22p2
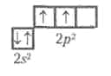
Для Карбону характерним є утворення чотирьох ковалентних зв'язків, обумовлене збудженням зовнішньої оболонки до стану 2s'2p3:
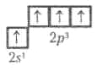
Тому Карбон здатний однаковою мірою як притягати, так і віддавати електрони. Хімічний зв'язок може здійснюватися за рахунок утворення sp3-, sp2- і sp-гібридних орбіталей, яким відповідають координаційні числа 4, 3 і 2. Кількість валентних електронів Карбону й кількість валентних орбіталей однакові — це одна з причин стійкості зв'язку між атомами Карбону.
Унікальна здатність атомів Карбону з'єднуватися між собою з утворенням міцних і довгих ланцюгів і циклів призвела до виникнення величезного числа різноманітних сполук Карбону, досліджуваних органічною хімією.
У сполуках Карбон виявляє ступені окиснювання – 4; +2; +4. Атомний радіус 0,77Е, ковалентні радіуси 0,77Е, 0,67Е, 0,60Е відповідно в одинарному, подвійному та потрійному зв'язках; іонний радіус С" 2,60 Е, С4+ 0,20 Е. При звичайних умовах Карбон хімічно інертний, при високих температурах він з'єднується з багатьма елементами, виявляючи сильні відновні властивості.
Усі форми вуглецю стійкі до лугів і кислот і повільно окиснюються тільки дуже сильними окиснювачами, наприклад, хромовою сумішшю (суміш концентрованих HN03 і КС103) або киснем:
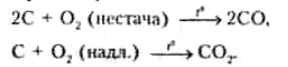
«Аморфний» вуглець реагує із фтором при кімнатній температурі, графіт і алмаз — при нагріванні. Безпосереднє з'єднання вуглецю з хлором відбувається в електричній дузі; із бромом і йодом вуглець не реагує, тому численні галогеніди Карбону синтезують непрямим шляхом. З оксигалогенідів загальної формули СОХ2 (де X — галоген) найбільш відомий хлорокис СОС12 (фосген).
При температурах вищих за 1 000 °С вуглець взаємодіє з металами, утворюючи карбіди.
Усі форми вуглецю при нагріванні відновлюють оксиди металів з утворенням вільних металів (Zn, Cd, Cu, Pb та ін.) або карбідів (Са2, Мо2С, WC, Та та ін.):
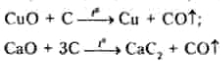
Вуглець реагує при температурах вищих за 600—800 °С з водяною парою і вуглекислим газом:
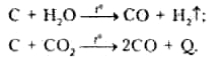
Усі форми вуглецю нерозчинні у звичайних неорганічних і органічних розчинниках, але розчиняються в деяких розплавлених металах (наприклад, Fe, Ni, Co).
НАРОДНОГОСПОДАРСЬКЕ ЗНАЧЕННЯ
Народногосподарське значення вуглецю визначається тим, що понад 90 % усіх первинних джерел споживаної у світі енергії припадає на органічне паливо, незважаючи на інтенсивний розвиток ядерної енергетики Тільки 10 % видобутого палива використовується як сировина для основного органічного синтезу й нафтохімічного синтезу, для отримання пластичних мас та ін.
КАРБОН В ОРГАНІЗМІ
Карбон - найважливіший біогенний елемент, що складає основу життя на Землі, структурна одиниця величезного числа органічних сполук, що беруть участь у побудові організмів і в забезпеченні їхньої життєдіяльності (біополімери, а також численні низькомолекулярні біологічно активні речовини - вітаміни, гормони, медіатори та ) Значна частина необхідної організмам енергії утворюється в клітинах за рахунок окиснювання вуглецю. Виникнення життя на Землі розглядається в сучасній науці як складний процес еволюції карбонових сполук.
Унікальна роль Карбону в живій природі обумовлена його властивостями, яких у сукупності не має жоден інший елемент періодичної системи Між атомами Карбону, а також між Карбоном й іншими елементами утворюються міцні хімічні зв'язки, які, однак, можуть бути розірвані в фізіологічних умовах (ці зв'язки можуть бути одинарними, подвійними і потрійними)
Здатність Карбону утворювати 4 рівнозначні валентні зв'язки з іншими ато мами створює можливість для побудови карбонових кістяків різних типів лінійних, розгалужених, циклічних.
Показово, що тільки всього три елементи (С, О, Н) складають 98 % загальної маси живих організмів. Цим досягається певна економічність у живій природі при практично безмежній структурній розмаїтості карбонових сполук невелика кількість типів хімічних зв'язків дозволяє набагато скоротити кількість ферментів, необхідних для розщеплення й синтезу органічних речовин
Особливості будови атома Карбону лежать в основі різних видів ізомерії органічних сполук (здатність до оптичної ізомерії виявилася вирішальною в біохімічній еволюції амінокислот, вуглеводів і деяких алкалоїдів).
Згідно з теорією О. І. Опаріна, перші органічні сполуки на Землі мали абюгенне походження. Джерелами вуглецю служили метан (СН4) і шаністий водень (НСН), що містилися в первинній атмосфері Землі 3 виникненням життя єдиним джерелом неорганічного вуглецю, за рахунок якого утворюється вся органічна речовина біосфери, є карбон (IV) оксид (С02), що знаходиться в атмосфері, а також у природних водах у розчиненому вигляді. Найпотужніший механізм засвоєння (асиміляція) вуглецю (у формі С02) — фотосинтез — здійснюється повсюдно зеленими рослинами. На Землі існує й еволюційно більш давній спосіб засвоєння С02 шляхом хемосинтезу; у цьому випадку мікроорганізми хемосинтетики використовують не променисту енергію Сонця, а енергію окиснювання неорганічних сполук.
Більшість тварин споживають вуглець із їжею у вигляді вже готових органічних сполук. У залежності від способу засвоєння органічних сполук прийнято розрізняти автотрофні й гетеротрофні організми
Застосування для біосинтезу білка й інших поживних речовин мікроорганізмів, що використовують як єдине джерело вуглецю вуглеводні нафти, — одна з важливих сучасних науково-технічних проблем.
Крім стабільних ізотопів Карбону, у природі розповсюджений радіоактивний І4С (в організмі людини його міститься 0,1 мкг). З використанням ізотопів Карбону в біологічних і медичних дослідженнях пов'язано чимало великих досягнень у вивченні обміну речовин і кругообігу вуглецю в природі. Так, за допомогою радіокарбонової мітки була доведена можливість фіксації вуглецю рослинами й тканинами тварин, встановлена послідовність реакції фотосинтезу, вивчено обмін амінокислот, простежені шляхи біосинтезу багатьох біологічно активних сполук і т. ін. Застосування ИС сприяло успіхам молекулярної біології у вивченні механізмів біосинтезу білка й передачі спадкової інформації. Визначення питомої активності НС у вуглецевмісних органічних залишках дозволяє судити про їхній бік, що використовується в палеонтології й археології.
ВИСНОВКИ
Все земне життя заснована на вуглеці. Кожна молекула живого організму побудована на основі вуглецевого скелета. Атоми вуглецю постійно мігрують з однієї частини біосфери (вузькою оболонки Землі, де існує життя) в іншу. На прикладі круговороту вуглецю в природі можна простежити в динаміці картину життя на нашій планеті.
Основні запаси вуглецю на Землі перебувають у вигляді міститься в атмосфері і розчиненого в Світовому океані діоксиду вуглецю, тобто вуглекислого газу (CO 2).Розглянемо спочатку молекули вуглекислого газу, що знаходяться в атмосфері. Рослини поглинають ці молекули, потім у процесі фотосинтезу атом вуглецю перетворюється на різноманітні органічні сполуки і таким чином включається в структуру рослин. Далі можливо кілька варіантів:
- Вуглець може залишатися в рослинах, поки рослини не загинуть. Тоді їх молекули підуть в їжу редуцентам (організмам, які харчуються мертвою органічною речовиною і при цьому руйнують його до простих неорганічних сполук), таким як гриби і терміти. Зрештою вуглець повернеться в атмосферу як CO 2;
- Рослини можуть бути з'їдені травоїдними тваринами. У цьому випадку вуглець або повернеться в атмосферу (в процесі дихання тварин і при їх розкладанні після смерті), або травоїдні тварини будуть з'їдені м'ясоїдними (і тоді вуглець знову ж повернеться в атмосферу тими ж шляхами);
- рослини можуть загинути і опинитися під землею. Тоді в кінцевому підсумку вони перетворяться на викопне паливо - наприклад, на вугілля.
У разі ж розчинення вихідної молекули CO 2 в морській воді також можливі декілька варіантів:
- вуглекислий газ може просто повернутися в атмосферу (цей вид взаємного газообміну між Світовим океаном і атмосферою відбувається постійно);
- вуглець може увійти в тканини морських рослин або тварин. Тоді він буде поступово накопичуватися у вигляді відкладень на дні Світового океану і врешті-решт перетвориться в вапняк або з відкладень знову перейде в морську воду.
Якщо вуглець увійшов до складу осадових відкладень або викопного палива, він вилучається з атмосфери. Протягом існування Землі вилучений таким чином вуглець заміщується вуглекислим газом, потрапляли в атмосферу при вулканічних виверженнях та інших геотермальних процесах. У сучасних умовах до цих природних факторів додаються також викиди при спалюванні людиною викопного палива. У зв'язку з впливом CO 2 на парниковий ефект дослідження круговороту вуглецю стало важливою задачею для вчених, що займаються вивченням атмосфери.
Складовою частиною цих пошуків є встановлення кількості CO 2, що знаходиться в тканинах рослин (наприклад, у щойно посадженому лісі) - вчені називають це стоком вуглецю. Оскільки уряди різних країн намагаються досягти міжнародної угоди з обмеження викидів CO 2, питання збалансованого співвідношення стоків та викидів вуглецю в окремих державах став головним яблуком розбрату для промислових країн. Проте вчені сумніваються, що накопичення вуглекислого газу в атмосфері можна зупинити одними лісопосадками.
Вуглець постійно циркулює в земній біосфері по замкнутих взаємопов'язаним шляхах. В даний час до природних процесів додаються наслідки спалювання викопного палива.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ:
1. Архаров. Л. М. Екологічні системи. Підручник для вищих навчальних закладів. – К.: Генеза, 1994 – 300 с.
2. Саранчук В. І. та ін. Вуглець: невідоме про відоме. - Донецьк: КК Центр, 2006
3. А.А. Горєлов. «Структура и функции экосистем». Экология. 1998г.
4.https://uk.wikipedia.org/wiki/%D0%92%D1%83%D0%B3%D0%BB%D0%B5%D1%86%D1%8C
- Глосарій термінів з хімії / Й. Опейда, О. Швайка, Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк : «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0.
- Деркач Ф. А. Хімія. — Л., 1968.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2004—2013.
1


про публікацію авторської розробки
Додати розробку
