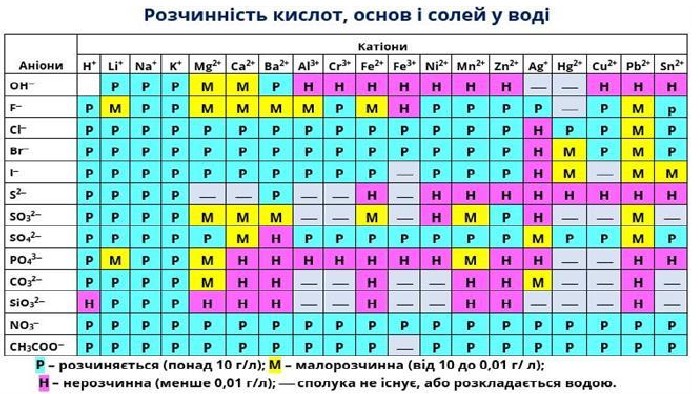
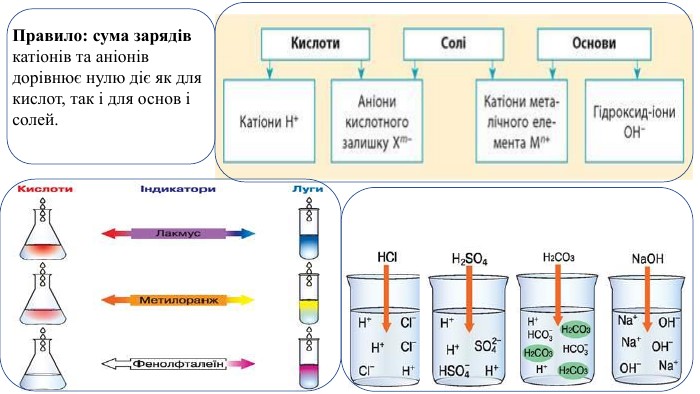
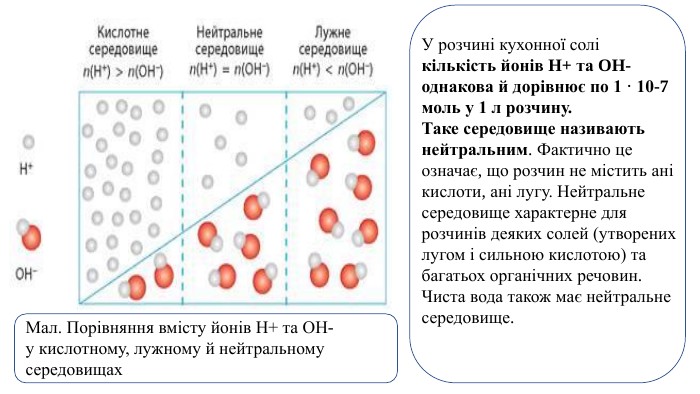
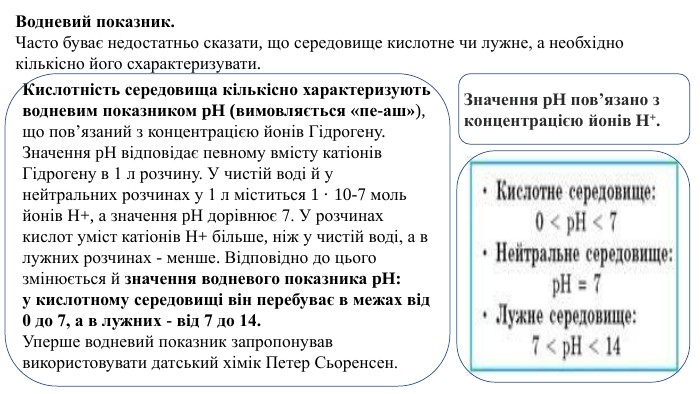
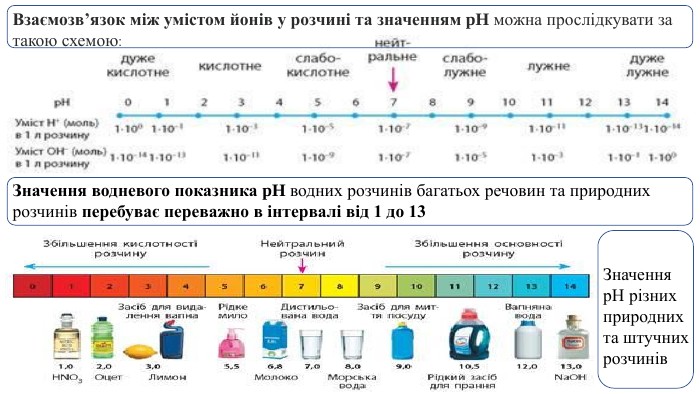
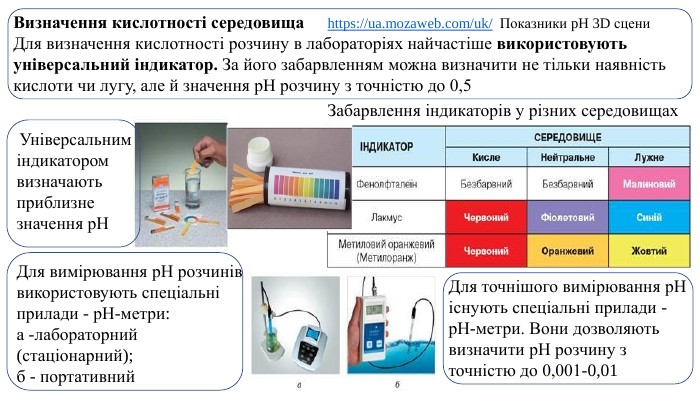
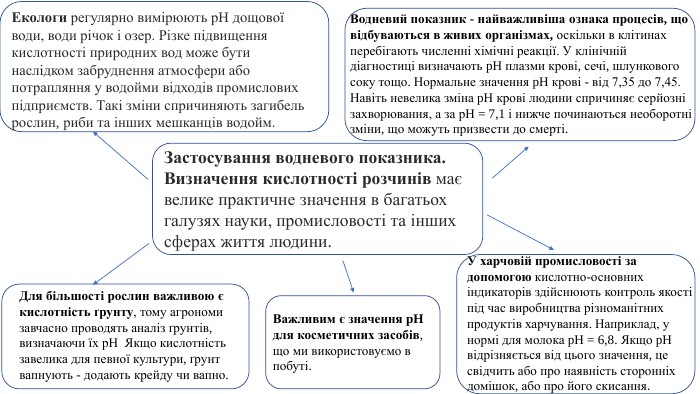
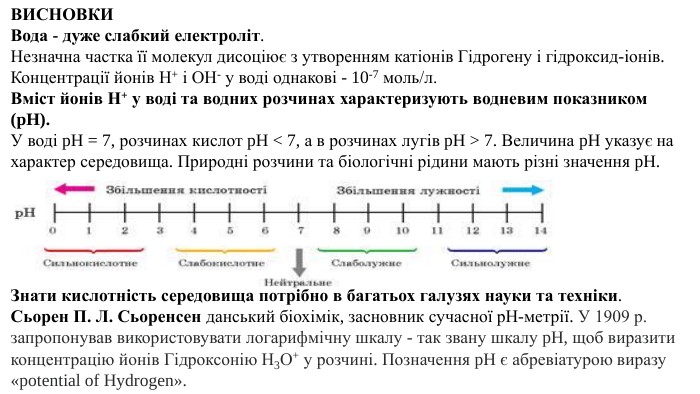
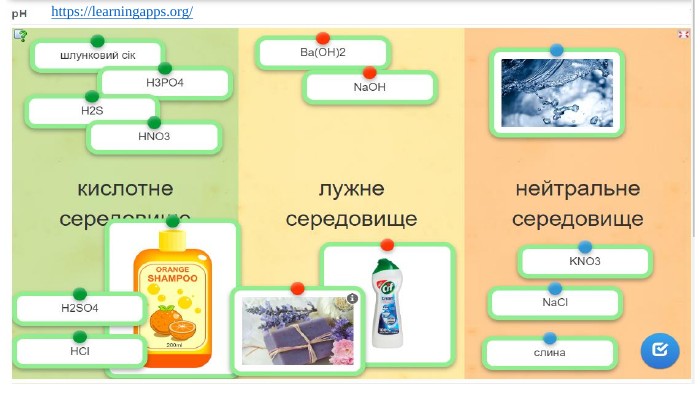
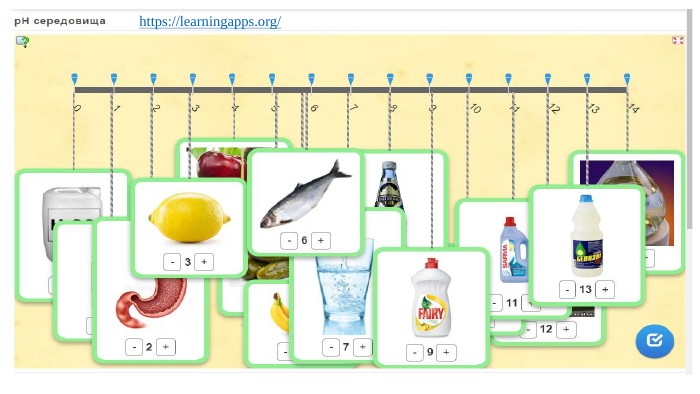
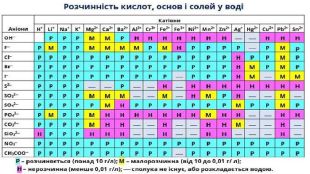
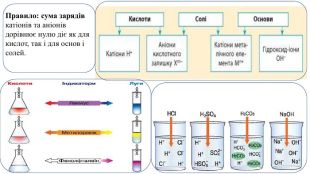
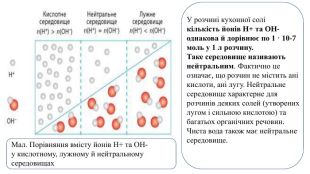
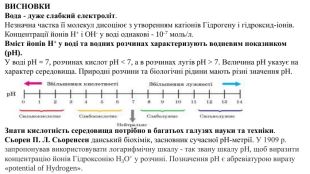
Презентація. Поняття про рН розчину. Значення рН для характеристики кислотного і лужного середовища. Виявлення в розчині гідроксид-іонів та йонів Гідрогену.
Про матеріал
Пропоную до уваги добірку навчального матеріала у вигляді презентації. Презентація за темою "Поняття про рН розчину. Значення рН для характеристики кислотного і лужного середовища. Виявлення в розчині гідроксид-іонів та йонів Гідрогену." може бути корисною та використана під час підготовки до уроку або під час уроку онлайн або офлайн заняття.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку