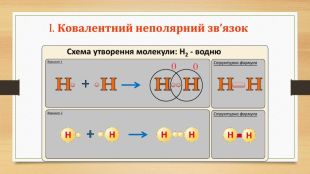
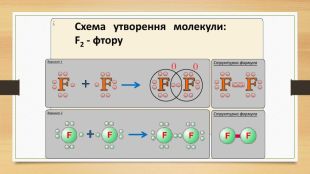
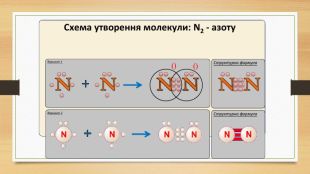
Презентація "Повторення за 8 клас ч.2"







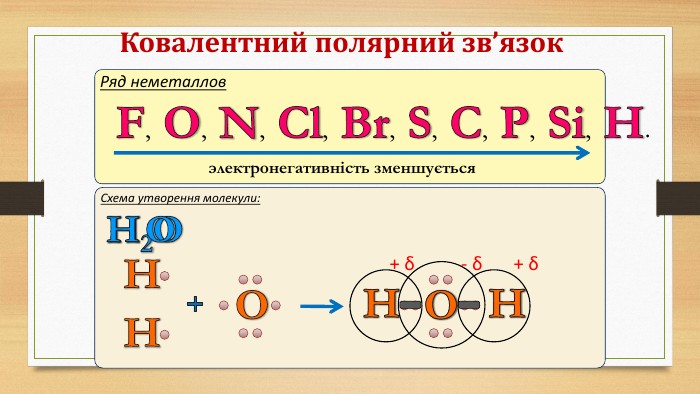
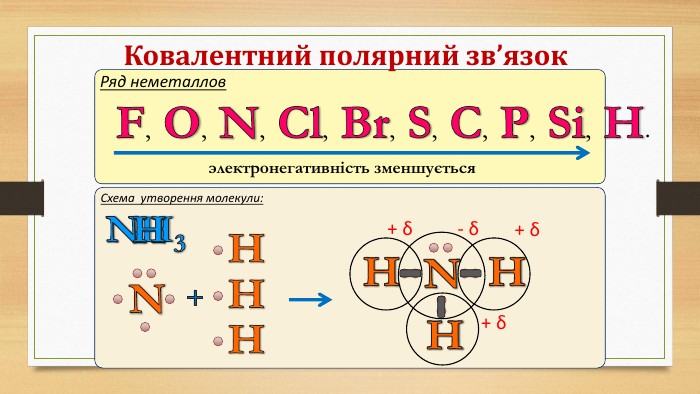











Електронегативність Електронегативність — здатність атома притягати до себе електрони інших атомів Відносна електронегативність відповідає Періодичному закону: у періодах із збільшенням номера елемента вона зростає, у групах — зменшується. Чим більша відносна електронегативність, тим сильніше елемент виявляє неметалічні властивості. Неметали характеризуються великою відносною електронегативністю, а метали — невеликою.
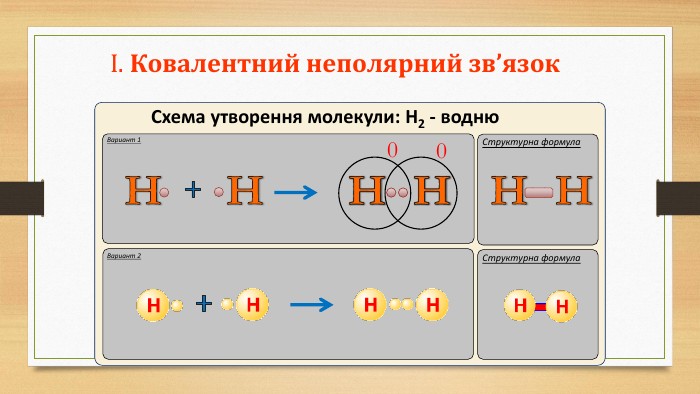
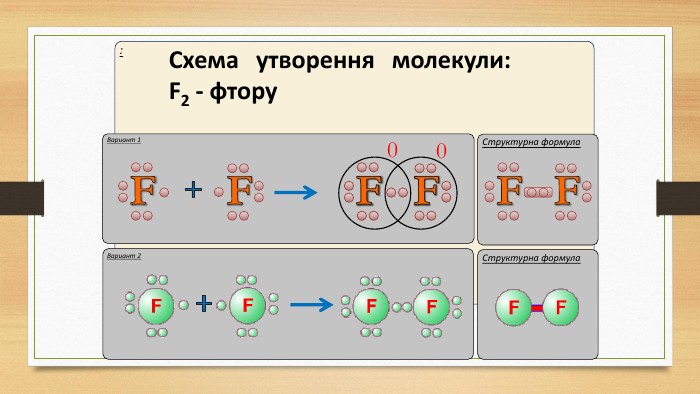
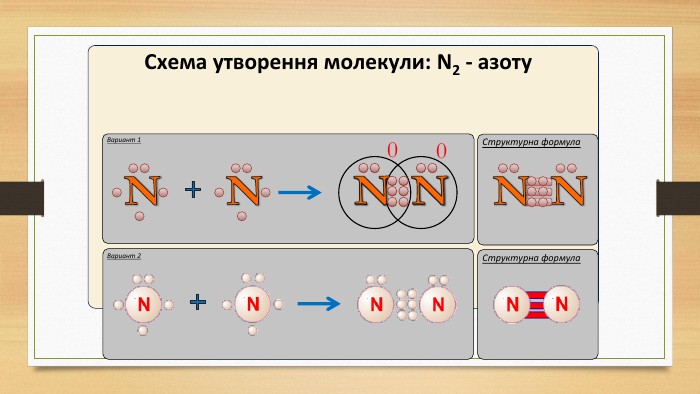
IІ. Ковалентний полярний зв’язок. Ряд неметаллов. F, O, N, Cl, Br, S, C, P, Si, H.электронегативність зменшується Элемент с большей ЭО, при образовании ковалентной полярной связи, приобретает частично отрицательный заряд (- δ). Далее Элемент з меншою ЕН, при утворенні ковалентного полярного зв’язку, отримує частковий позитивний заряд (+ δ).
Визначити види з’язків. Na. Сl СF4 N2 NH3 ССl4 Н2 S O2 Nа. F ОF2 Mg. O SР6 F2. Йонний. Ковалентний полярний. Ковалентний неполярний. Ковалентний полярний. Ковалентний полярний. Ковалентний полярний. Ковалентний неполярний. Йонний. Ковалентний полярний. Йонний. Ковалентний полярний. Ковалентний неполярний
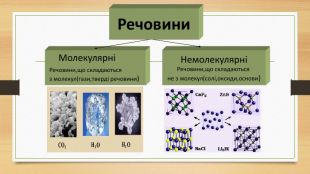
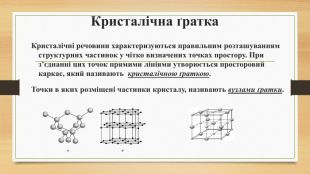
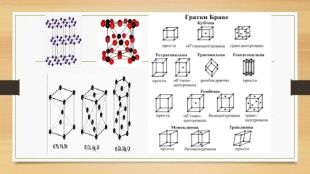
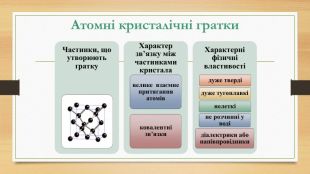
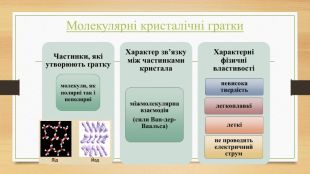
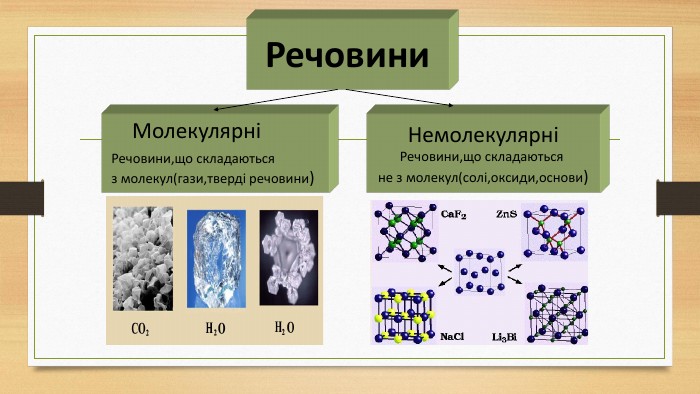
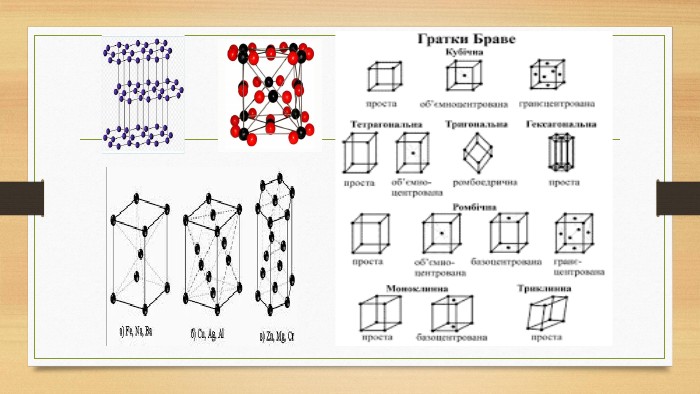
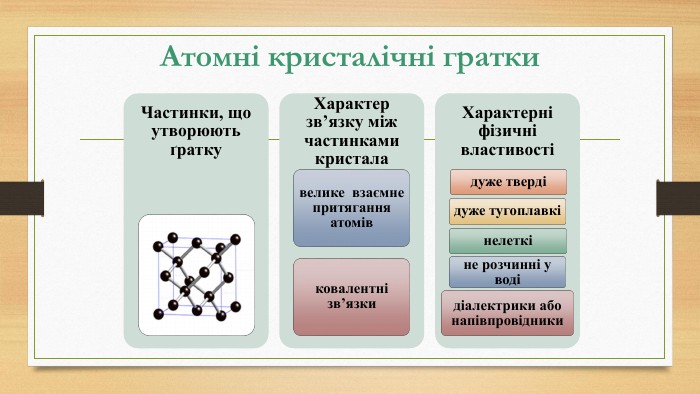
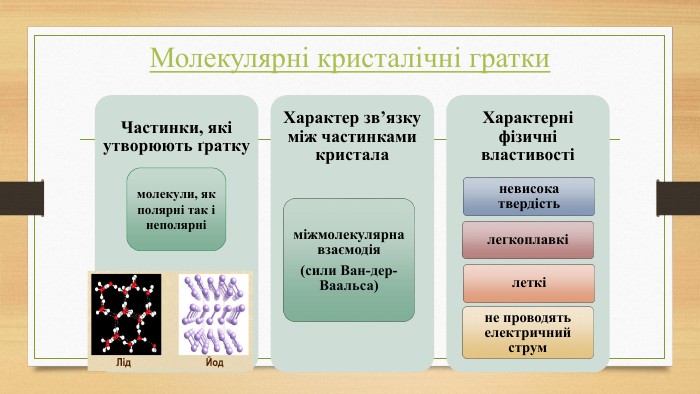
Кристалічна ґратка. Кристалічні речовини характеризуються правильним розташуванням структурних частинок у чітко визначених точках простору. При з’єднанні цих точок прямими лініями утворюється просторовий каркас, який називають кристалічною ґраткою. Точки в яких розміщені частинки кристалу, називають вузлами ґратки.


про публікацію авторської розробки
Додати розробку