Презентація «Природа хімічного зв’язку. 8 клас
Про матеріал
Презентація допоможе в проведенні уроку на тему: «Природа хімічного зв'язку». Електронегативність атомів хімічних елементів. Чому атоми інших елементів з'єднуються один з одним в молекули. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку










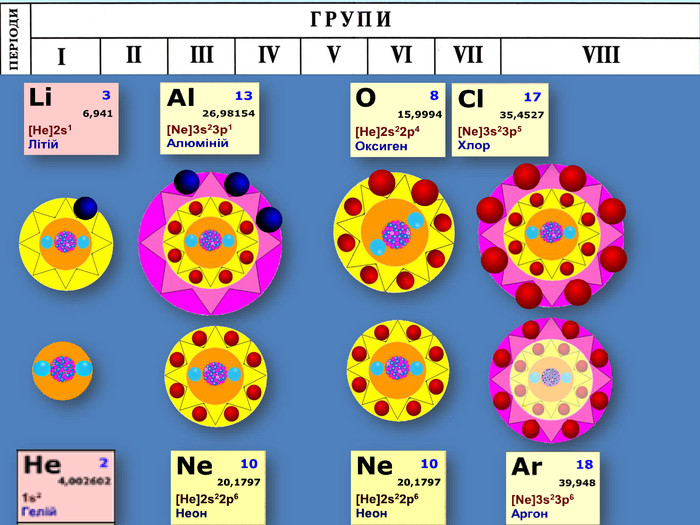
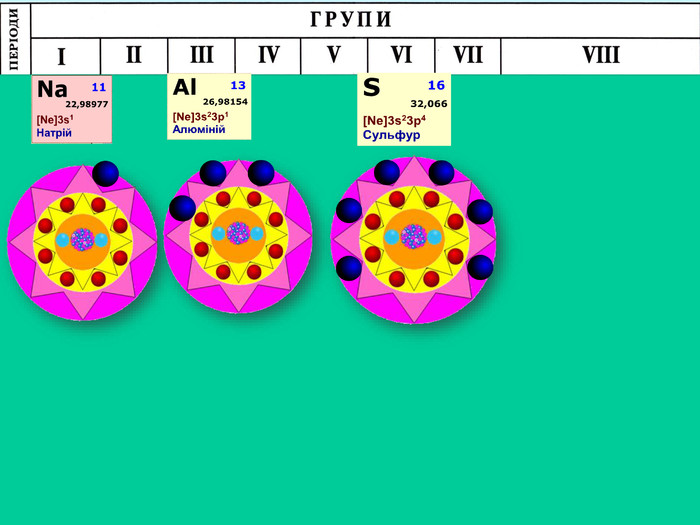




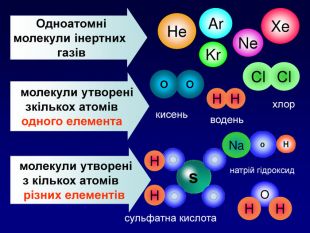






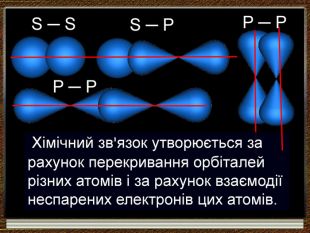

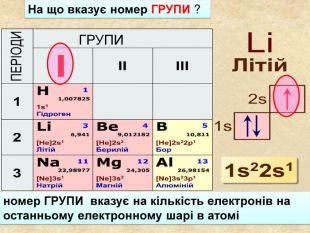
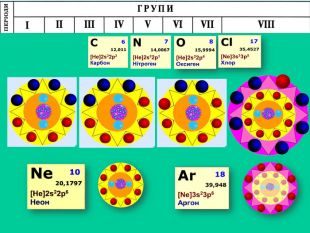

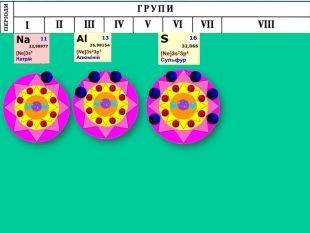


-

Юсин Надія Улянівна
18.11.2024 в 19:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Міщенко Галина Миколаївна
29.10.2024 в 09:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чоп Наталя
06.11.2023 в 20:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рибачок Наталія Борисівна
16.11.2022 в 06:54
Дякую за презентацію, чудовий інтерактивний виклад матеріалу.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
08.11.2022 в 14:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мыща Светлана
12.05.2022 в 10:09
Дуже дякую за презентацію
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
14.11.2021 в 18:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Скоробогач Віра Володимирівна
14.11.2021 в 10:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
06.11.2021 в 17:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Караченцева Наталія Миколаївна
13.11.2018 в 11:44
сподобалось, дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Караченцева Наталія Миколаївна
13.11.2018 в 11:44
сподобалось, дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 8 відгуків