Презентація "Прості речовини :метали та неметали "
Про матеріал
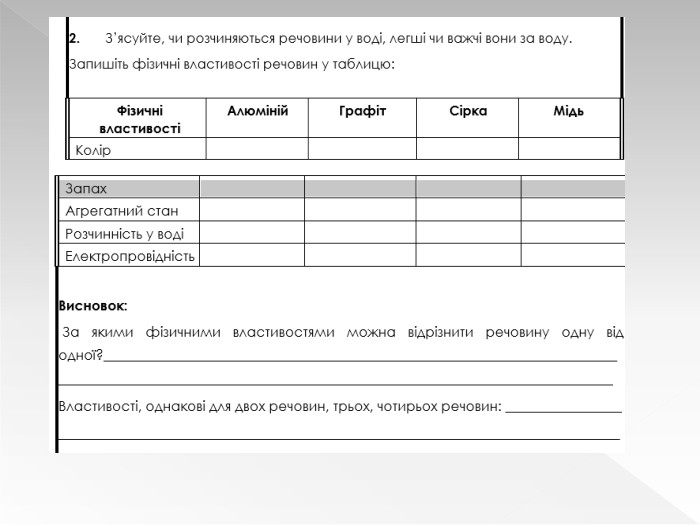
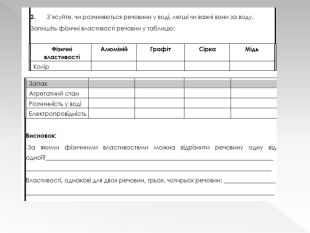
Урок оцінюється за групою результатів 1 виконують навчальне дослідження №3.
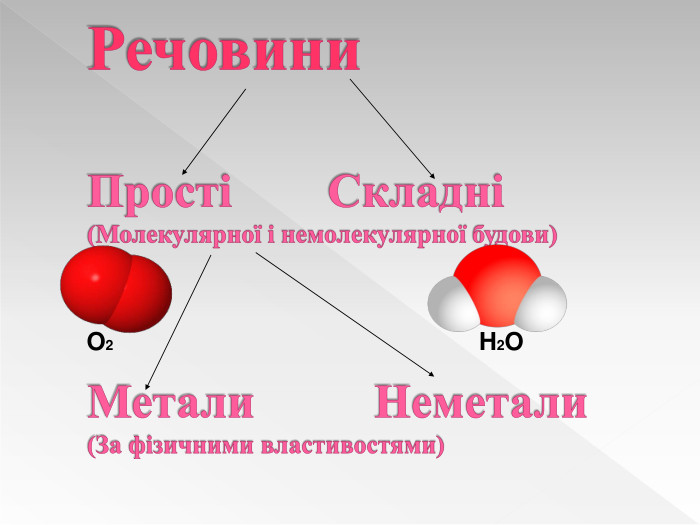
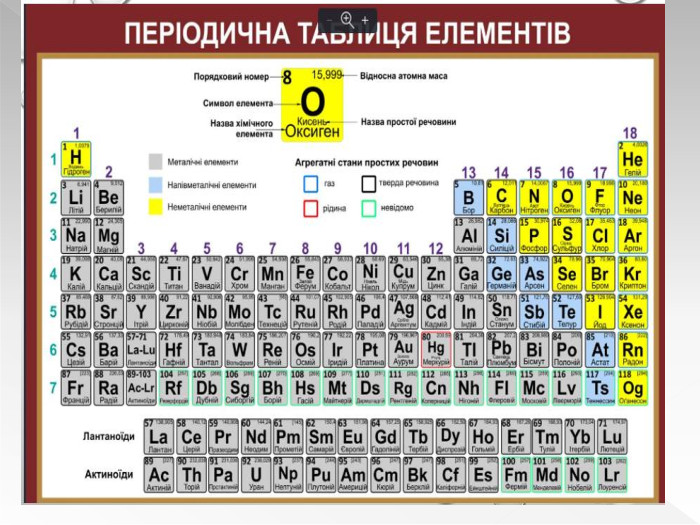
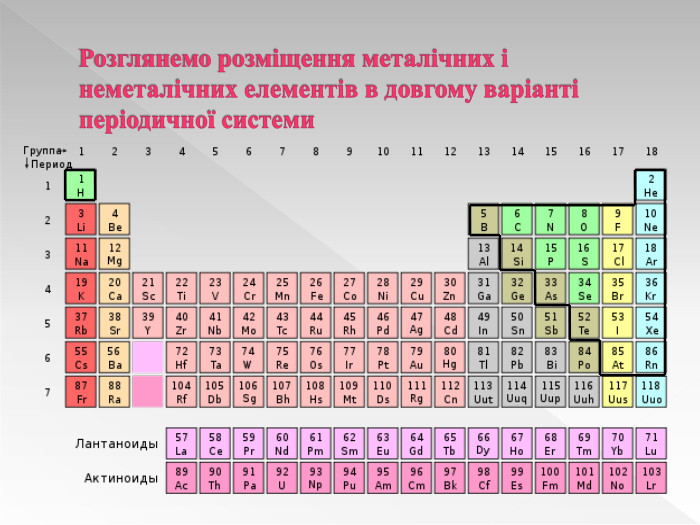
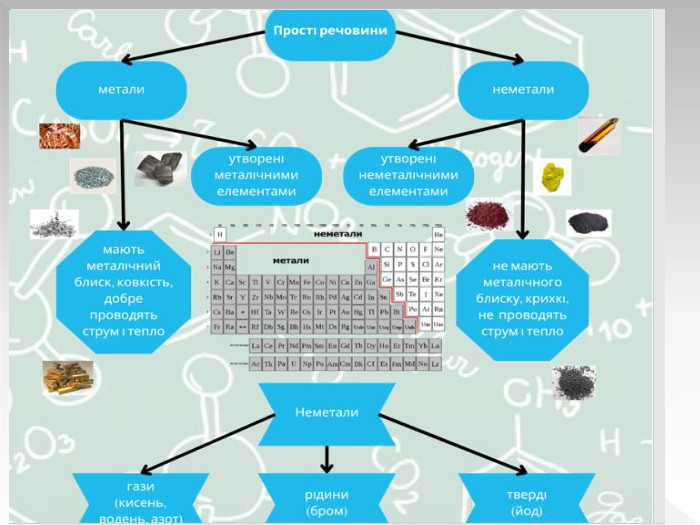
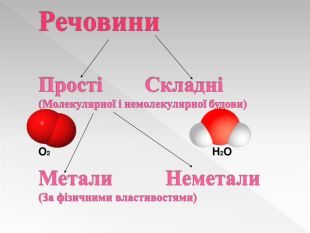
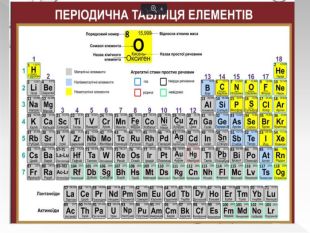
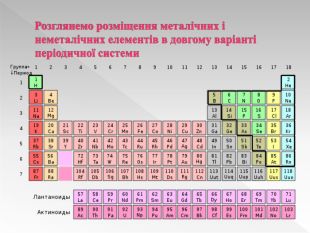
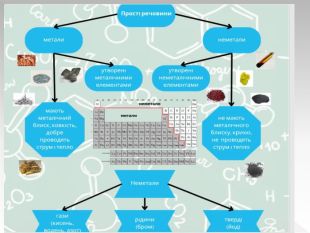
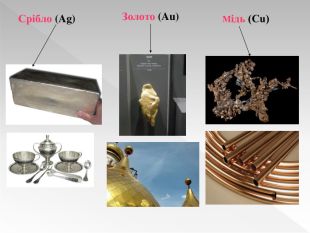
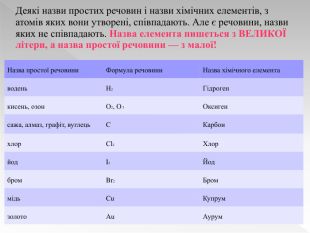
Прості речовини : метали та неметали підготовлено презентацію .Під час уроку учні дізнаються про різноманітність речовин у навколишньому світі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку