Презентація "Реакції обміну між розчинами електролітів, умови їх перебігу. Йонно-молекулярні рівняння хімічних реакцій."
Про матеріал
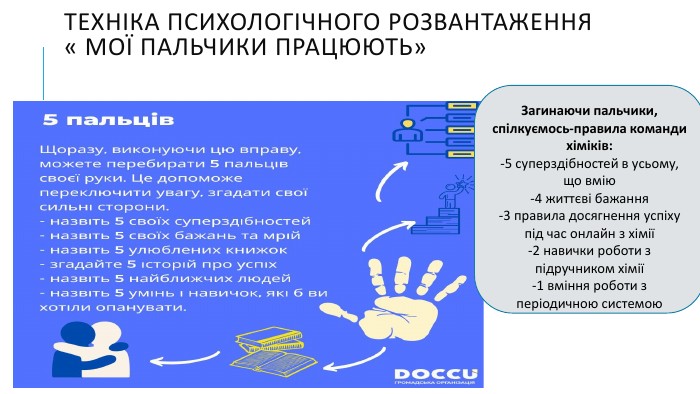
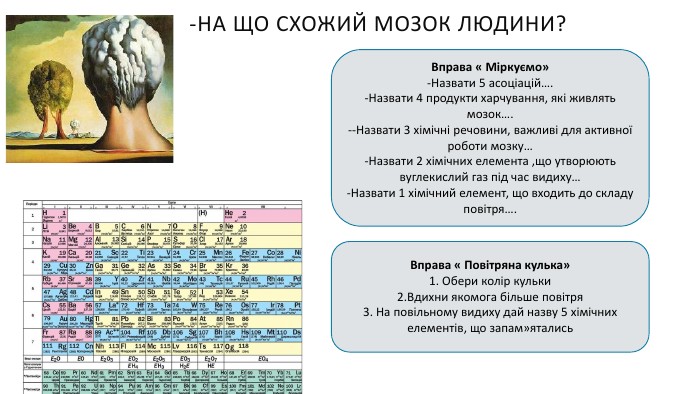
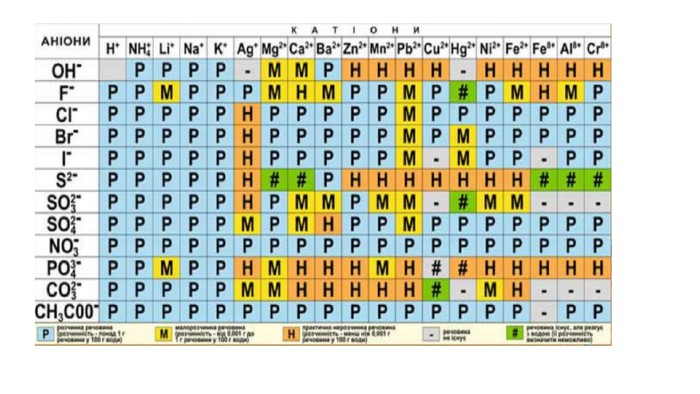
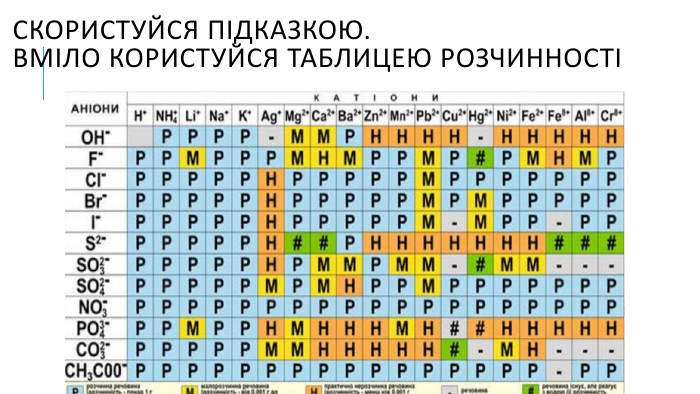
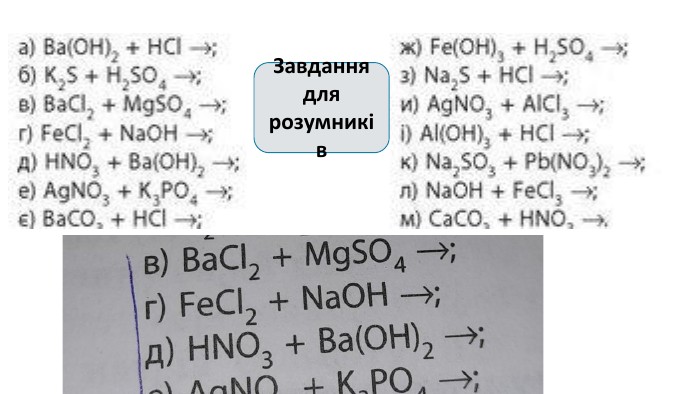
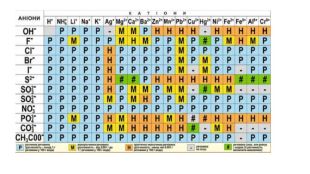
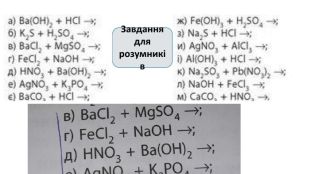
Створення блок-опори відповіді з темою "Йонно-молекулярні рівняння реакції" Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку