Презентація «Кисень» 7 клас
| Повітря, його склад. Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню. Добування кисню в лабораторії та промисловості. Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню. |



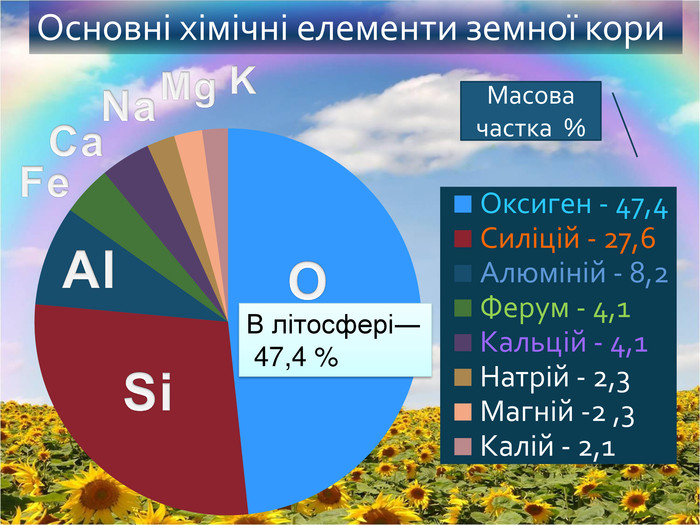
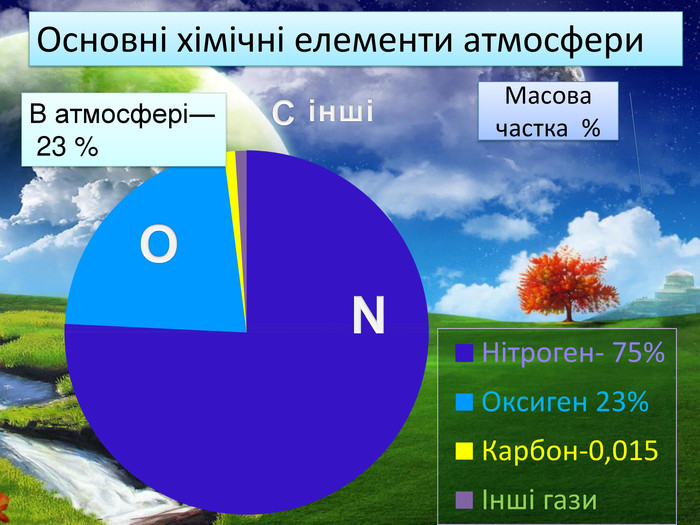
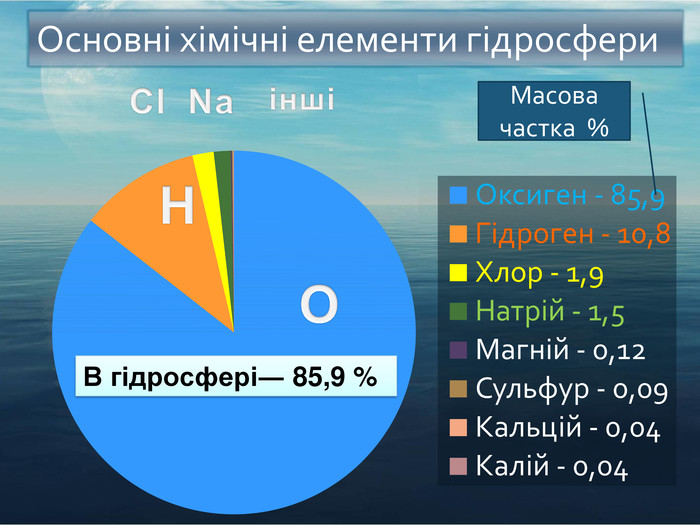

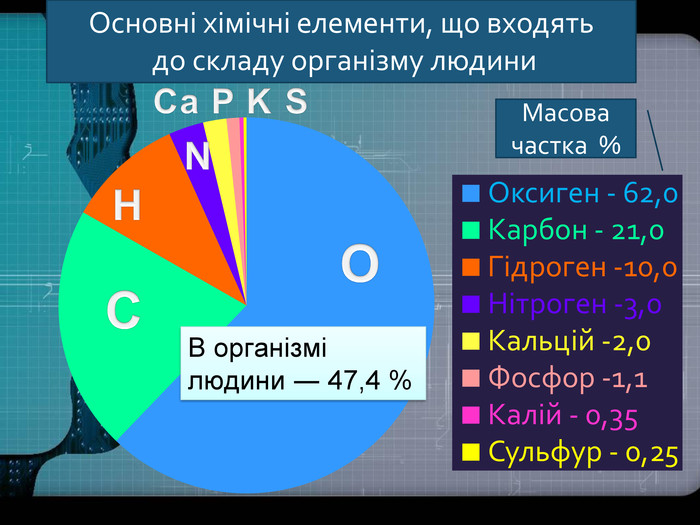


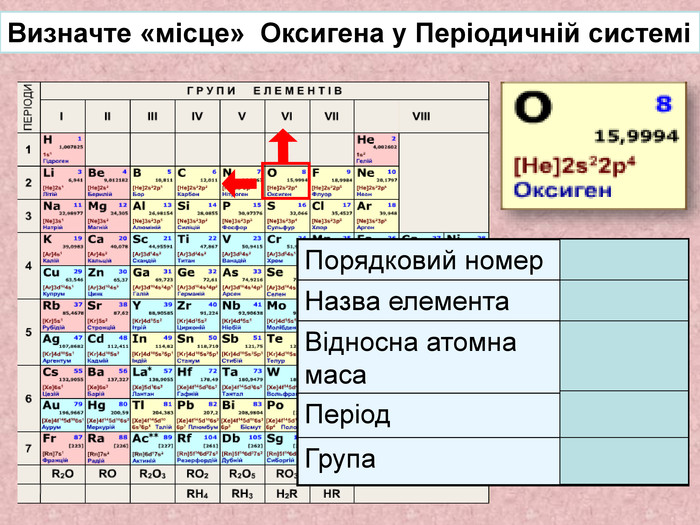



































Кисень. Кисень ― проста речовина. О2 Молекула кисню складається з двох атомів Оксигену. Атоми Оксигену можуть утворювати ще одну просту речовину озон. О3 Фізичні властивості кисню. Безбарвний газ, без смаку і запаху, малорозчинний у воді. Трохи важчий за повітря. За тиску 760 мм рт. ст.і температури -183 С зріджується, а при зниженні температури до -219 С твердне. У рідкому і твердому станах забарвлений у блакитний колір.
1773 р. Карл Вільгельм Шеєлє шведський хімік описав кисень під назвою “вогняне повітря”. Він добув його в результаті нагрівання деяких речовин. Термічний розклад гідраргірум (ІІ) оксиду (оксиду ртуті): 2 Hg. O= 2 Hg + 02;Історія відкриття кисню1774 р. Джозеф Пристлі відкрив кисень, досліджуючи газоподібні речовини, що виділялися під час розжарювання різних речовин сонячним промінням з допомогою лінзи
Добування кисню в лабораторії В лабораторії кисень добувають з тих його сполук, які містять Оксиген. Їх називають оксигеновмісні сполуки, які під час нагрівання розкладаються і легко виділяють кисень.video Розклад перманганату калію (марганцівка) КСl. O3 Na. NO3 Н2 O2 Hg. OКMn. О4 КMn. О4
Каталізаторами розкладу гідроген перексиду може виступати не тільки манган (ІV) оксид, але і речовини, що містяться в крові тварин та людини. Тому гідроген перексид, який ще називають перекис водню використовують для обробітку дрібних ран. Кисень, що виділяється при розкладі згубно діє на бактеріїКаталізатор — речовина, яка пришвидшує протікання певної хімічної реакції, але не входить до складу продуктів реакції.2 H2 O2 = 2 H2 O + O2
Na. NO3 KCl. O3 Hg. OTермічний розклад калій хлорату (бертолетова сіль) за присутності каталізатора (Мn. О2) 2 КСl. О3 = 2 КСl + 3 O2↑;t. Мп02 Teрмічний розклад натрій (або калій) нітрату: 2 Na. NO3 = 2 Na. NO2 + O2↑;О термічний розклад гідраргірум (ІІ) оксиду (оксиду ртуті): 2 Hg. O = 2 Hg + O2↑
У рівняннях реакції з лівого боку рівняння (вихідні речовини) записана одна речовина, а в продуктах реакції ― декілька2 H2 O2 = 2 H2 O + O2 Реакції, в результаті яких з однієї складної речовини утворюється декілька інших (простих чи складних), називають реакціями розкладу.вихідні речовини(реагенти)продукти реакції
Добування кисню в промисловості Виділення кисню при нагріванні зрідженого повітря. Першим при нагріванні рідкого повітря випаровується азот (температура кипіння -196°С), потім кисень (температура кипіння -183 °С); Електроліз води. Електроліз — це розклад речовин, який відбувається під дією електричного струму.2 Н2 О = О2 + 2 Н2
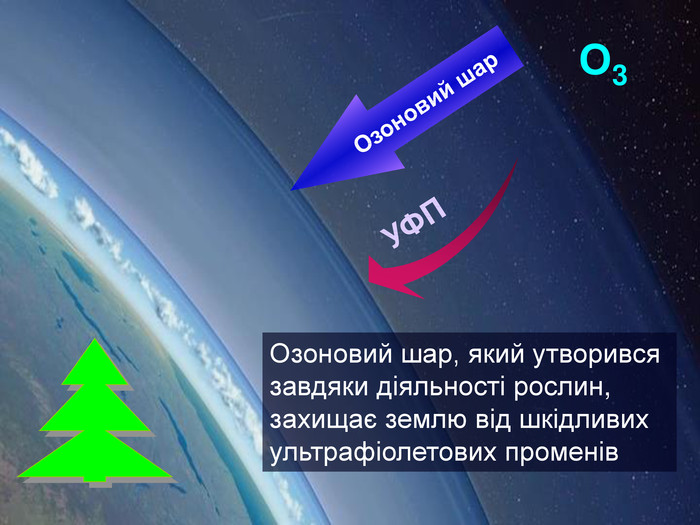
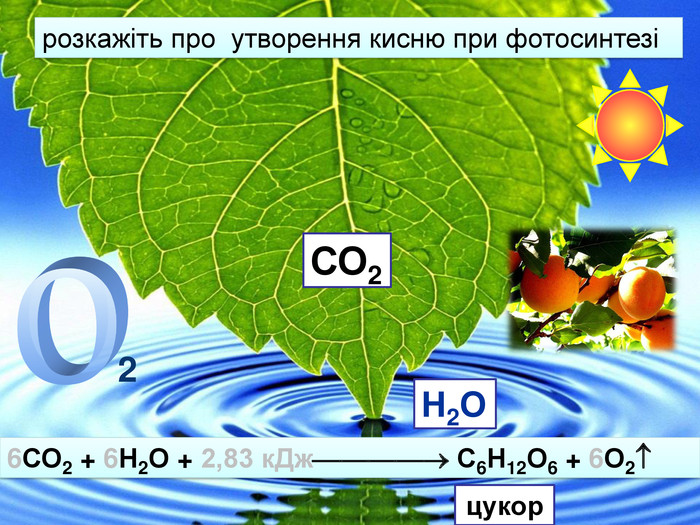
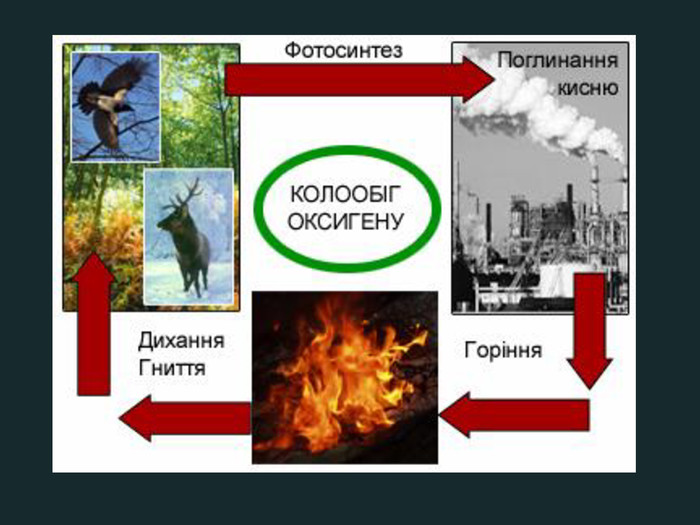
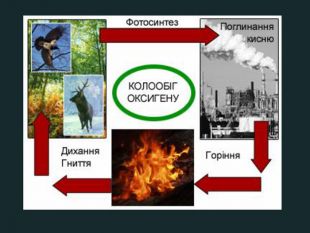
Кругообіг Оксигену в природіКругообіг — сукупність процесів у природі, під час яких атоми елемента внаслідок реакцій переходять від одних речовин до інших.зв'язування кисню при диханні, згорянні палива, окисненні різних речовин;взаємоперетворення оксигеновмісних сполук; С + О2 = СО2взаємодія вуглекислого газу з вологою повітря:со2 + н2о = н2со3утворення нерозчинних карбонатів в природних джерелах води з розчинних солей;
П. П. Попель, Л,С. Крикля Хімія. Підручник для 7 кл. Київ. Видавничий центр “Академія”, 2016 Григорович О. В. Хімія.7 клас Розробки уроків Х.: Вид-во “Ранок”, 2007. Шаповалов С. А. Довідник старшокласниката абітурієнта. Х. Торсінг, 2005. Старовойтова І. Ю. Усі уроки хімії. 7 клас. Х.: Вид. група “Основа”, 2007. Хімія. Практичний довідник 7-9 клас. / Авт.-упорядник Курмакова І. М. та інші – Чернігів: КММЕДІА, 2015.


про публікацію авторської розробки
Додати розробку










































-

Шубіна Вікторія Вікторівна
01.04.2024 в 20:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коріненко Світлана Іванівна
12.02.2023 в 15:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Хаблак Людмила
06.02.2023 в 16:52
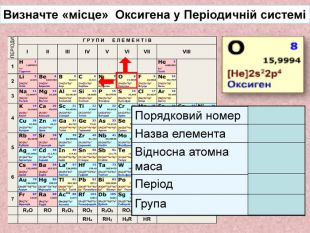
У слайді оксиген написано, що Оксиген знаходиться в 3 періоді. В 7 класі не доцільно називати електронну будову атома оксигена. Презентація перегружена зайвим матеріалом, що відволікає учнів та витрачає час. В іншому добре.
Загальна:
3.3
Структурованість
3.0
Оригінальність викладу
3.0
Відповідність темі
4.0
-

фертак наталя
01.02.2022 в 21:58
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Маринкова Майя Євгенівна
10.01.2022 в 00:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бурда Тетяна Валеріївна
03.02.2021 в 16:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гевел Дар'я Олександрівна
22.05.2020 в 16:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арзуманова Ірина Юріївна
22.02.2019 в 07:53
Дуже дякую! Цікава ,змістовна презентація! Успіхів!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Машков Вадим Віталійович
18.02.2019 в 23:11
Дякую! Презентація дуже чудова з логічним і структурованим матеріалом
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Табас Людмила
06.02.2019 в 05:50
Дякую. Увесь потрібний матеріал зібрано в одну презентацію.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
03.12.2018 в 12:06
Дякую за допомогу. Змістовно, яскраво.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Виноградова Людмила Анатоліївна
19.03.2018 в 20:21
Дякую. Виручили. Потрібен матеріал з цієї теми.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 9 відгуків