Презентація "Розрахункові задачі 8 клас"
Про матеріал
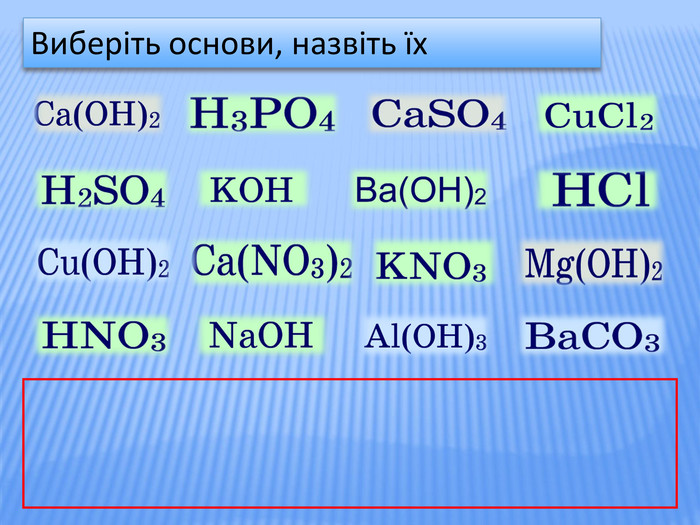
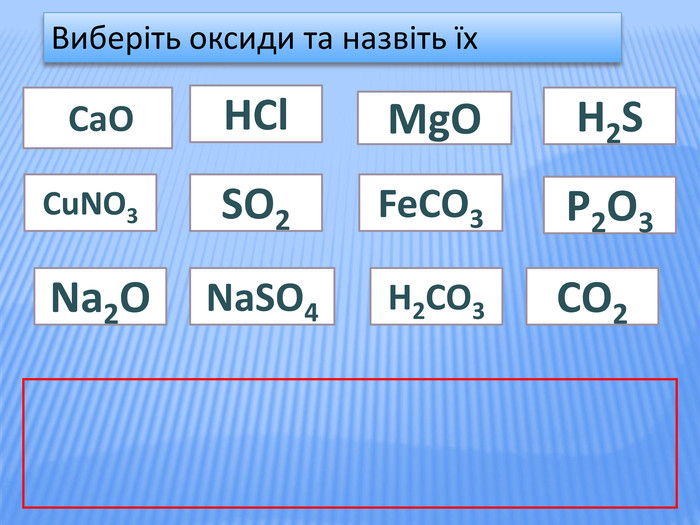
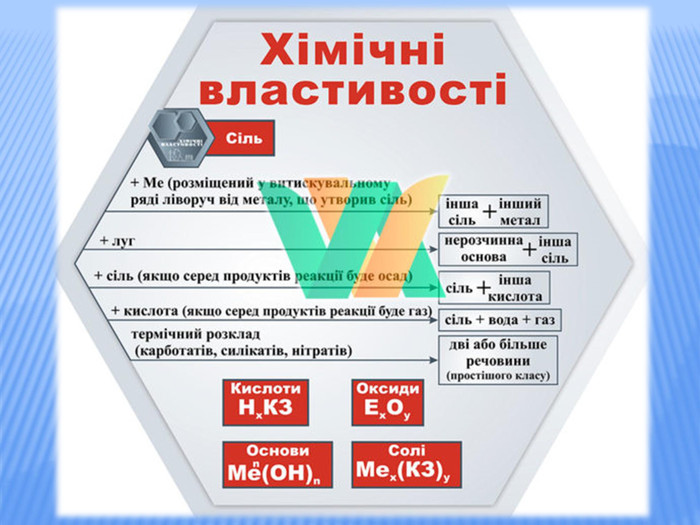
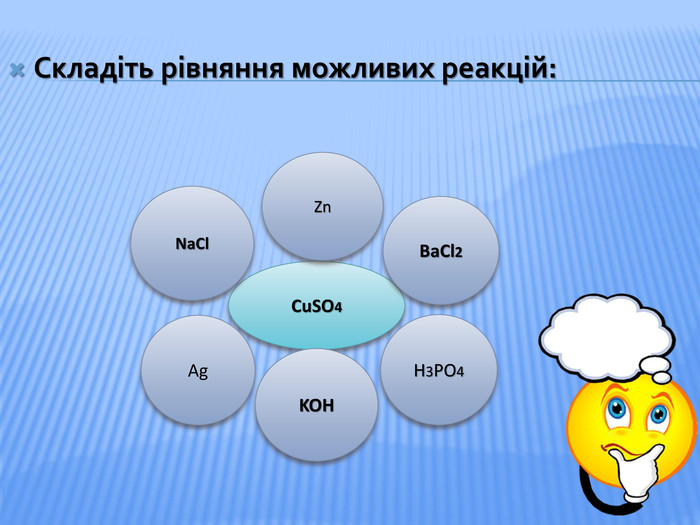
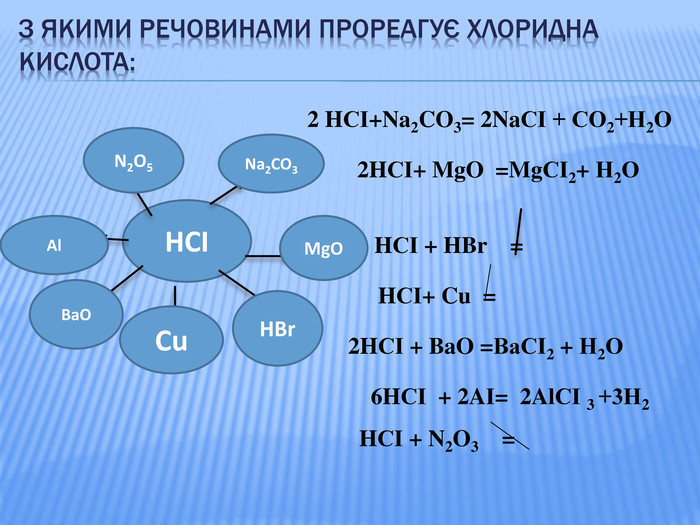
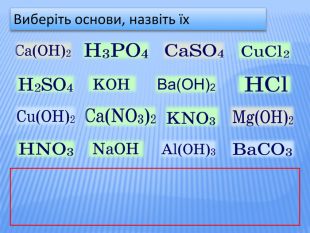
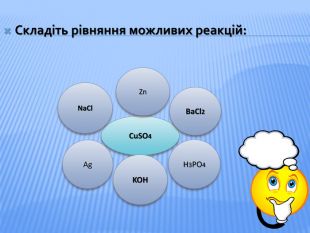
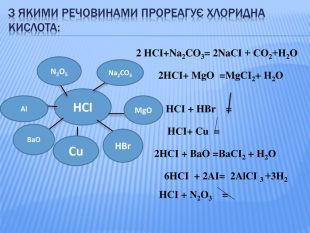
Урок стане у нагоді при організації дистанційного уроку у синхронному режимі. Можна використати для удосконалення умінь учнів класифікувати та називати речовини основних класів неорганічних сполук, розв'язувати задачі на знахлдження маси, об'єму, кількості речовини реагентів та продуктів реакції та умінь складати хімічні рівняння. Для учнів 8 класу та при підготовці до ЗНО Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку