Презентація "Склад, властивості, застосування метану, етану, етену,етину"
Про матеріал
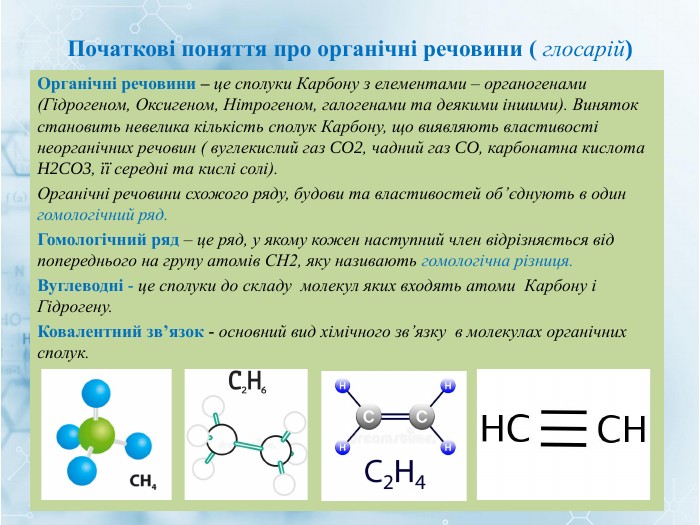
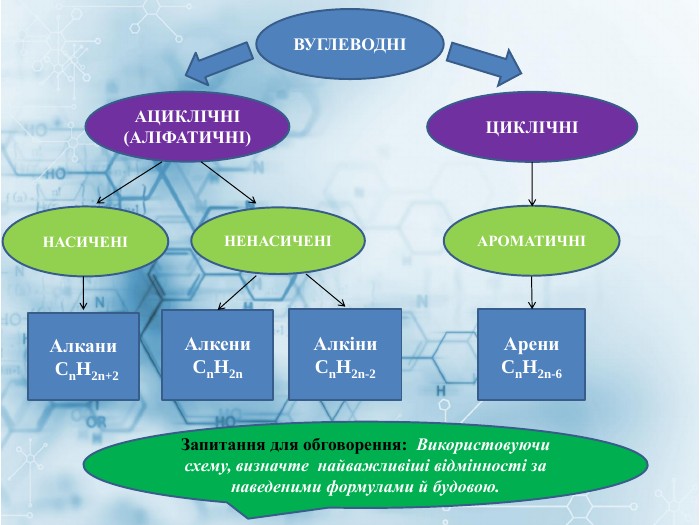
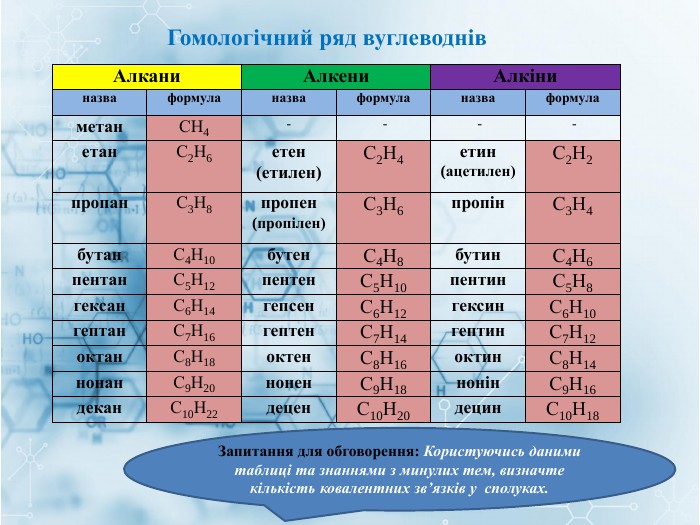
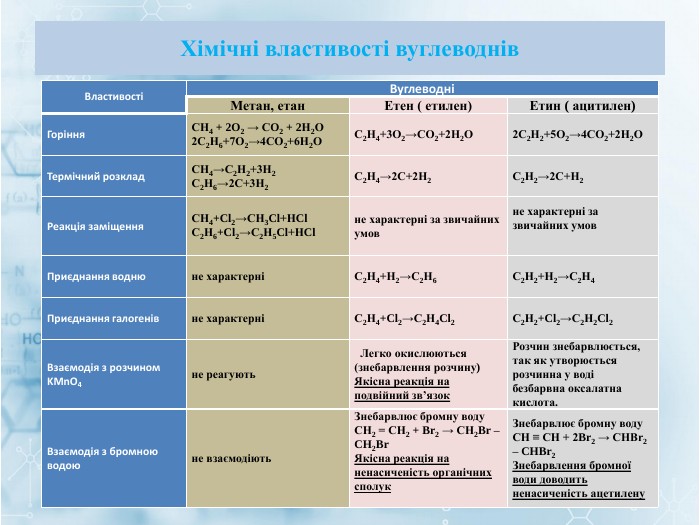
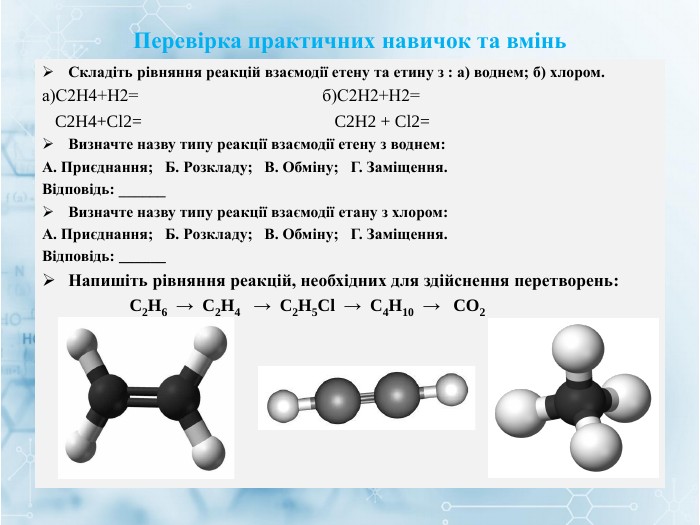
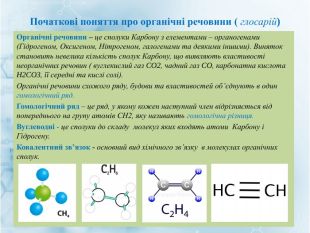
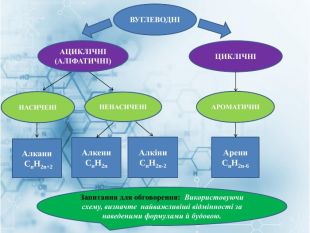
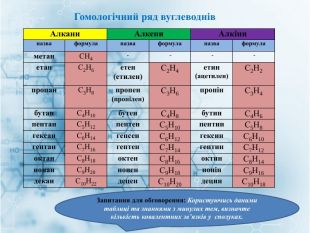
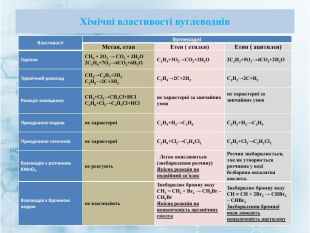
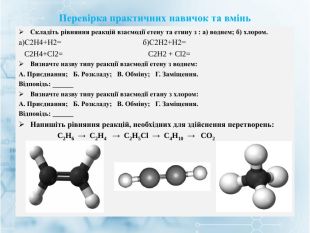
Матеріал містить інформацію про початкові поняття в органічній хімії (глосарій); схему - класифікацію вуглеводнів та їх гомологічний ряд, дані про основні властивості та застосування предстваників насичених та ненасичених вуглеводнів, запитання для обговорення і завдання для перевірки практичних навичок та вмінь. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку