Презентація: Сполуки неметалічних елементів з Гідрогеном
Матеріал призначений для викладачів та студентів закладів передвищої фахової освіти



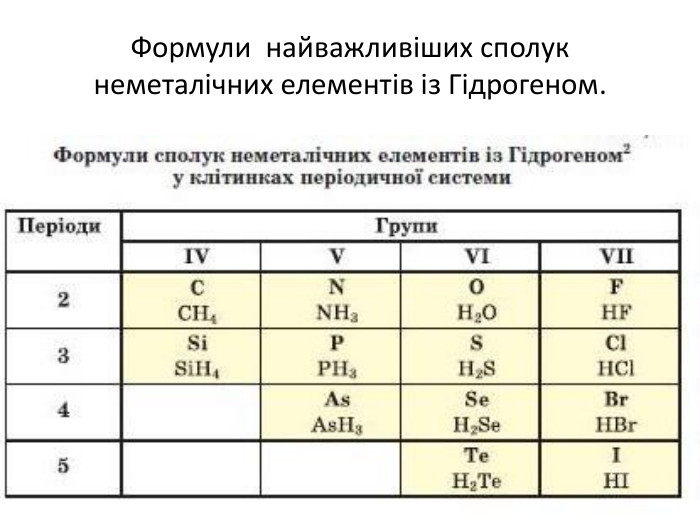



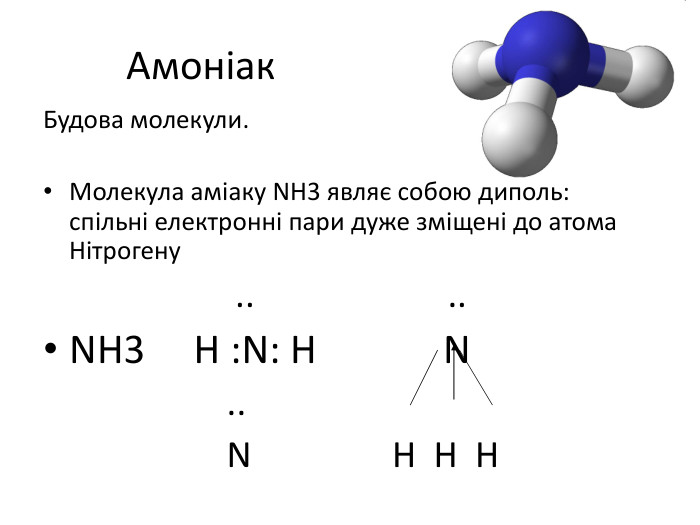















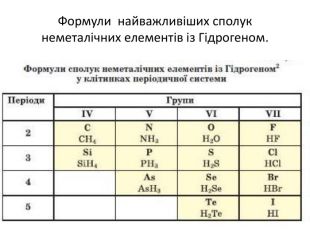
Сполуки неметалічних елементів з Гідрогеном Сполуки з Гідрогеном відомі для більшості неметалічних елементів; їх не утворюють лише інертні елементи. Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко. к Ступінь оиснення елемента визначається наступним чином: від номеру групи віднімаємо 8
Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НnЕ і ЕНn. Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним. Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку
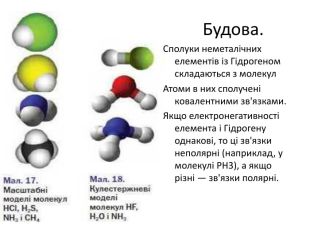
Фізичні властивості. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НF (за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким. Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами
Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С). Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині. Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації. Розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном у воді виявляють властивості кислот. Водні розчини НСL, НВг і НІ поводяться як сильні одноосновні кислоти, НF — як кислота середньої сили, а Н2S — як слабка двохосновна кислота.
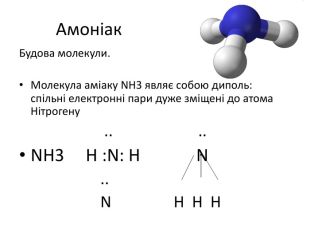
Властивості амоніаку. Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за – 33,4ОС, він переходить у рідкий стан. Маса 1 л амоніаку за нормальних умов дорівнює 0,77 г. При охолодженні до 33,4єС амоніак під звичайним тиском перетворюється у прозору рідину, що твердне при – 77,8єС. Амоніак добре розчинний у воді: 1:700. Розчинність амоніаку у воді зумовлена утворенням водневим зв’язків між їхніми молекулами
Для амоніаку характерні реакції приєднання і окислення. 1.Взаємодіє з водою і утворює гідрати NH3.H2O, NH3+H2O=NH4OH. Лужна реакція розчину амоніаку наявністю . Водний розчин NH3 – амоній гідроксид (слабка основа). Фенолфталеїн – малинове забарвлення, розчин NH3 10% нашатирний спирт. 2. Взаємодія з кислотами. Утворюються солі амонію: NH3+HCl=NH4Cl; 2NH3+H2SO4=(NH4)2SO4 3.Відновні властивості (при нагріванні). а) згорає у кисні: 4NH3+3О2=2N2+6Н2О; б)каталітичне окислення: 4NH3+5О2=4NО+6Н2О; в)реагує з окислювачами: 4H3N +3Br2=6НBr+3N2; 2NH3+3CuO=3Cu+N2+3H2O.
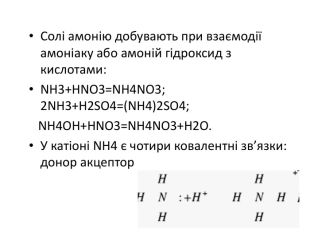
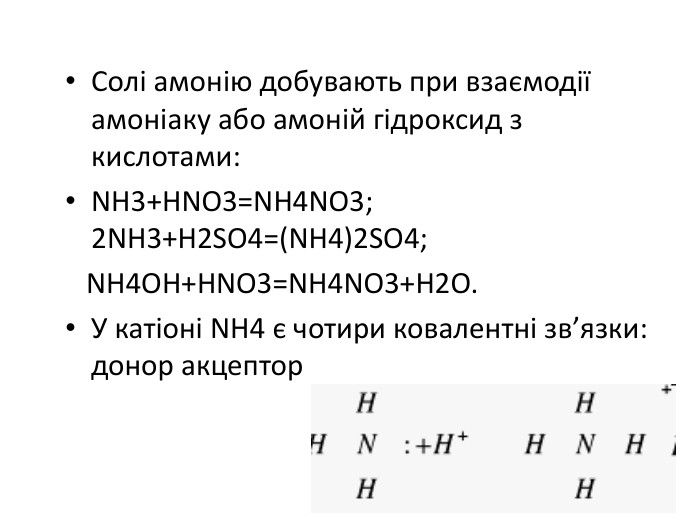
Якісна реакція на йон амонію 1) взаємодія з лугами: NH4 CL+КОН =NH3 +H2O +KCL у пробірку з сіллю або розчином, що аналізують, додають розчин лугу і суміш обережно нагрівають. При наявності NH4 виділяється амоніак. Довести наявність аміаку можна вологим лакмусовим папірцем, що синіє в його присутності, або за різким неприємним запахом
Солі амонію. СОЛІ АМОНІЮ — це кристалічні речовини з йонним типом зв'язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку. Фізичні властивості. Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.
ВЗАЄМОДІЯ АМОНІАКУ ТА ХЛОРОВОДНЮ З ВОДОЮ. Аміак добре розчиняється у воді утворюючи аміачну воду (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH3). Висока розчинність аміаку пояснюється тим, що він реагує з водою. Водний розчин гідроген хлориду називають хлоридною кислотою. Тривіальна назва цього розчину — соляна кислота.
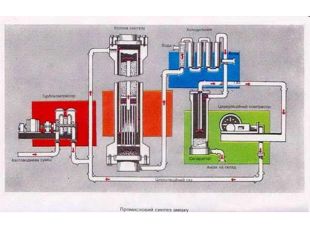
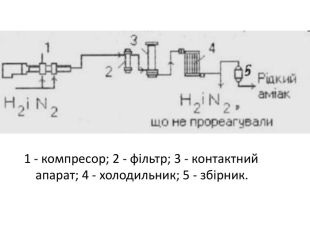
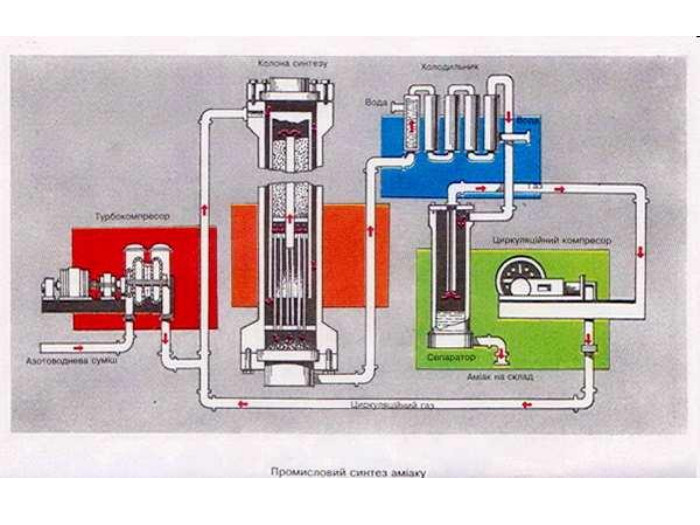
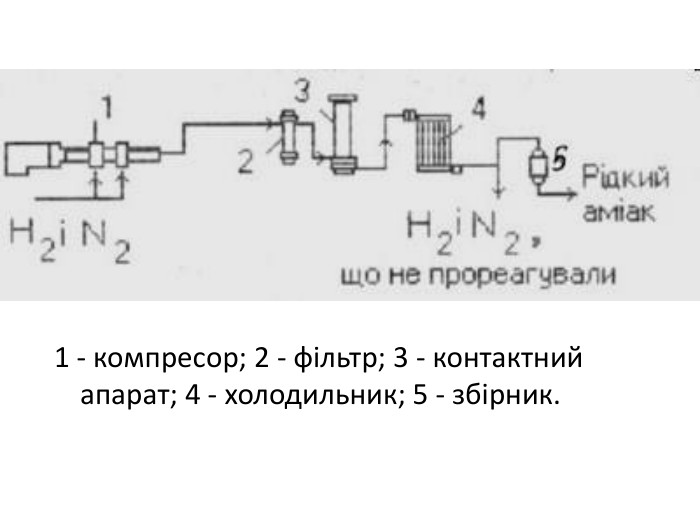
Добування У лабораторії амоніак добувають, нагріваючи амоній хлорид гашеним вапном. 2NH4Cl+Ca(OH)2=CaCl2+H2O+2NH3 Амоніак, що утворився висушують СаО. У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція азоту з воднем екзотермічна, вона відбувається із виділенням теплоти.
Застосування. Аміак — важливий продукт хімічної промисловості. Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди. Як холодоагент аміак застосовують у холодильниках. У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO. Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
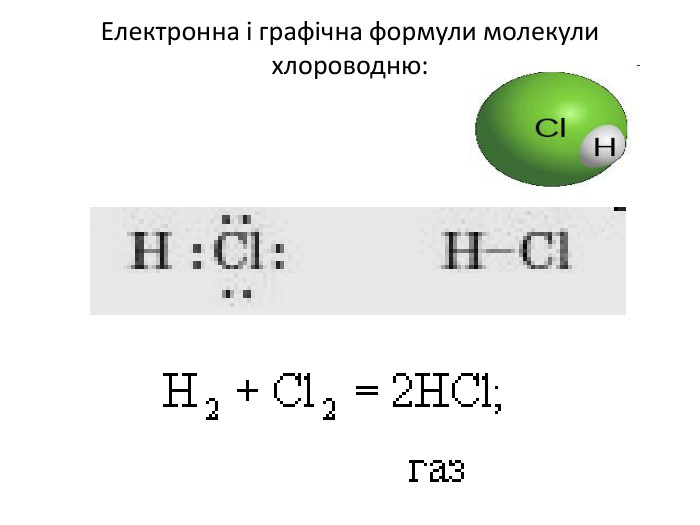
Розчин хлороводню у воді називають хлоридною, або соляною, кислотою. Поява кислотних властивостей хлороводню в розчині обумовлюється тим, що полярна будова молекул HCl під впливом дуже полярних молекул води переходить в іонну, внаслідок чого молекули хлориду водню у розчині дисоціюють:
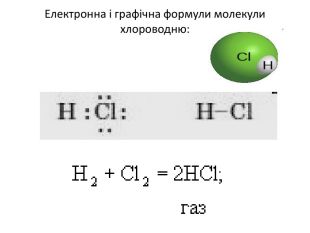
Хлороводень (HCl) — безбарвний задушливий газ з різким запахом. Температура розплавлення: −115 °C (158 K), температура кипіння: −85 °C (188 K), У лабораторних умовах хлороводень одержують при дії концентрованої сульфатної кислоти на хлорид натрію при сильному нагріванні: 2NaCl + Н2SO4 = Na2SO4 + 2HCl ↑ У промисловості його добувають звичайно спалюванням водню в атмосфері хлору у спеціальних пальниках: H2 + Cl2 = 2HCl


про публікацію авторської розробки
Додати розробку