Презентація " Способи добування основ і амфотерних гідроксидів"
Про матеріал
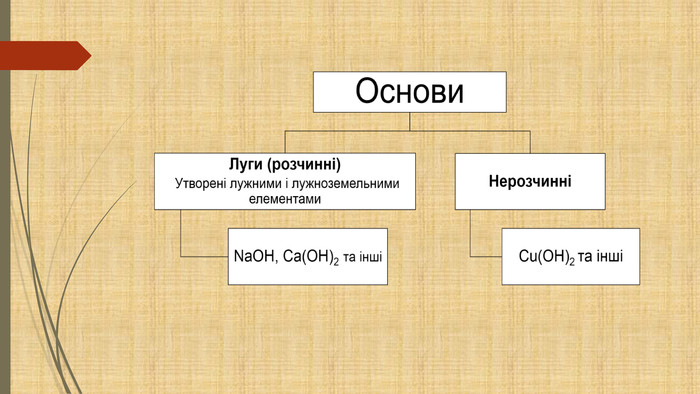
Презентація містить матеріал для повторення, відео досліди, рівняння хімічних реакцій. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку