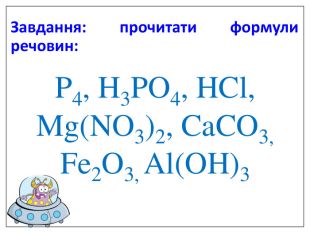
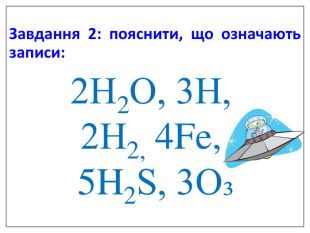
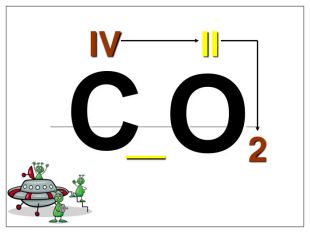Презентація "Валентність. Складання формул бінарних сполук за валентністю елементів."


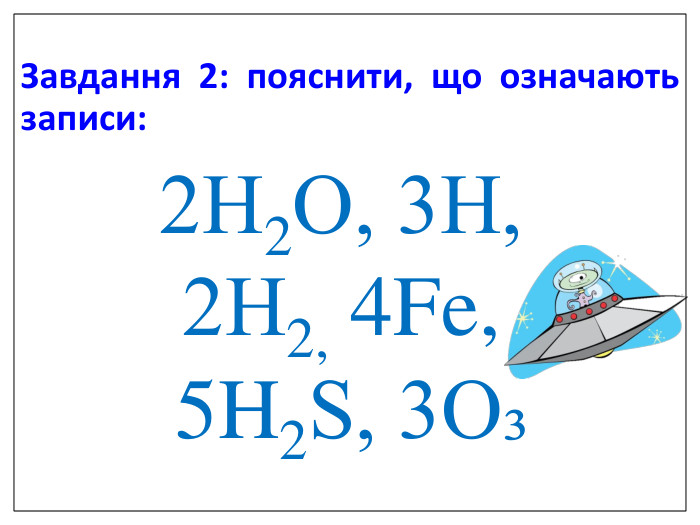



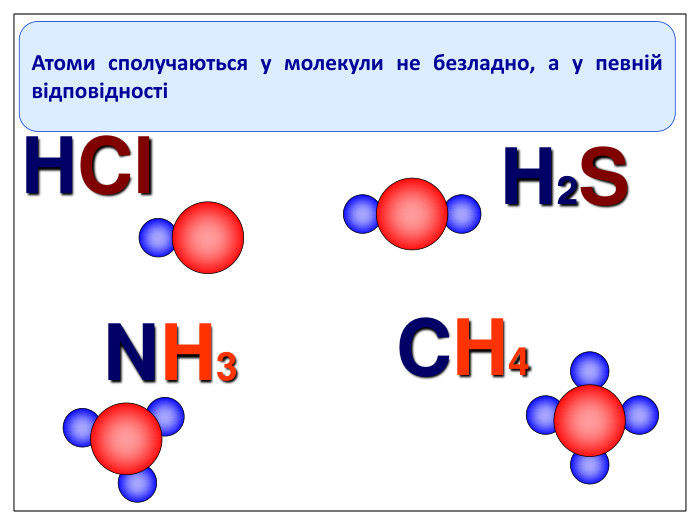

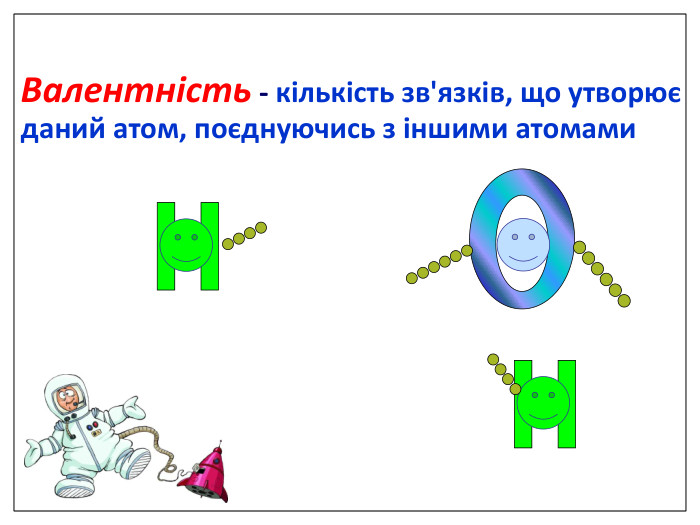




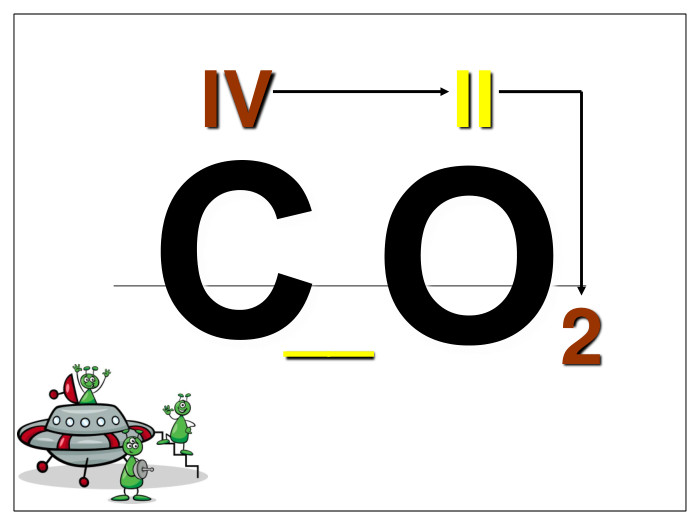




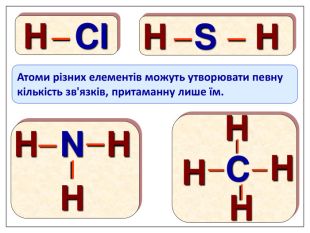
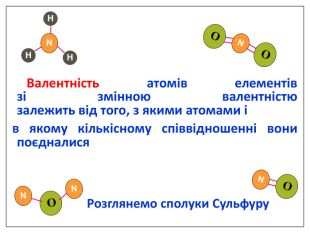
Ще три сотні років тому вчені встановили, що атоми з'єднуються в молекули не безладно, а в певній послідовності за допомогою зв'язків, які називають хімічними. Тоді атоми уявляли у вигляді кульок, що мають “гачки”, за допомогою яких вони сполучались один з одним. Тільки багато років потому була встановлена істина природа хімічного зв‘язку. Зверніть увагу
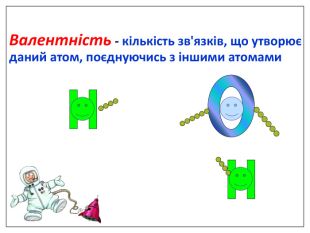
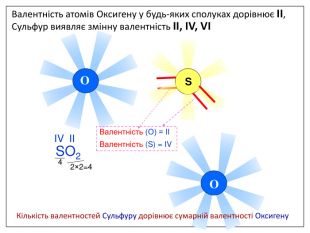
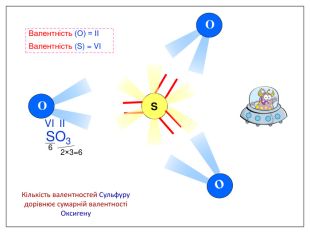
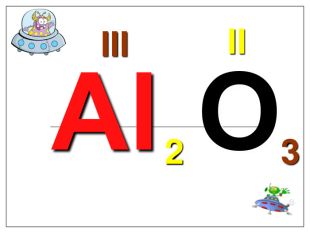
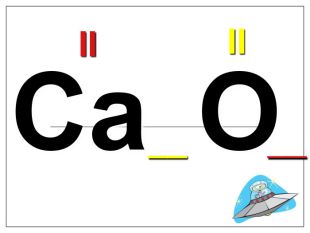
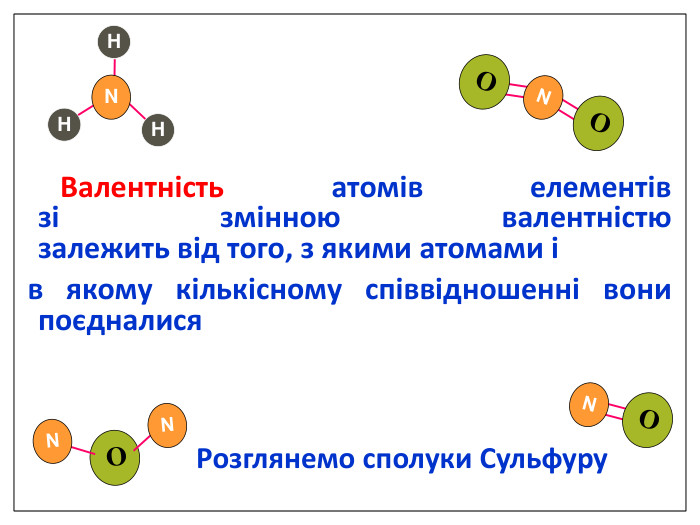
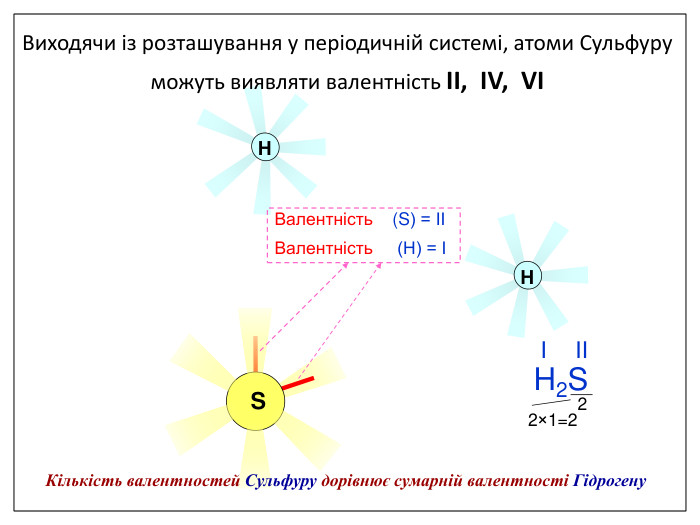
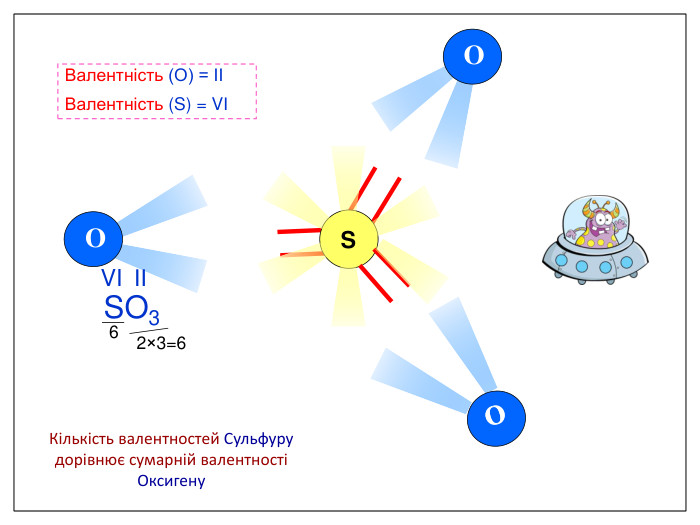
Валентність залежить від будови атома і визначається за положенням у періодичній системі. Валентність Стала Змінна Валентність (Н) = І Валентність (О) = ІІ Валентність (F) = І Максимальна валентність = № групи. (виключення О = ІІ, Fe = ІІ, ІІІ) Мінімальна валентність ( неметалів у сполуках із металами і Н) = 8 – № групи. Проміжні валентності = максимальна валентність мінус числа кратні двом. Валентність елементів І,ІІ,ІІІ груп = № групи (виключення Cu = I і ІІ) У бінарних сполуках сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності усіх атомів другого елемента
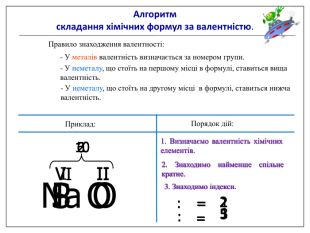
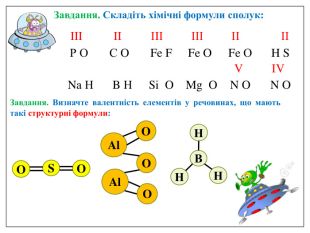
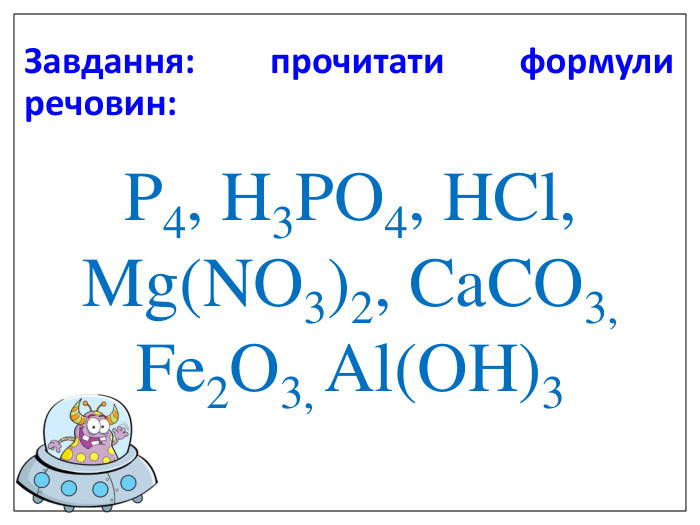
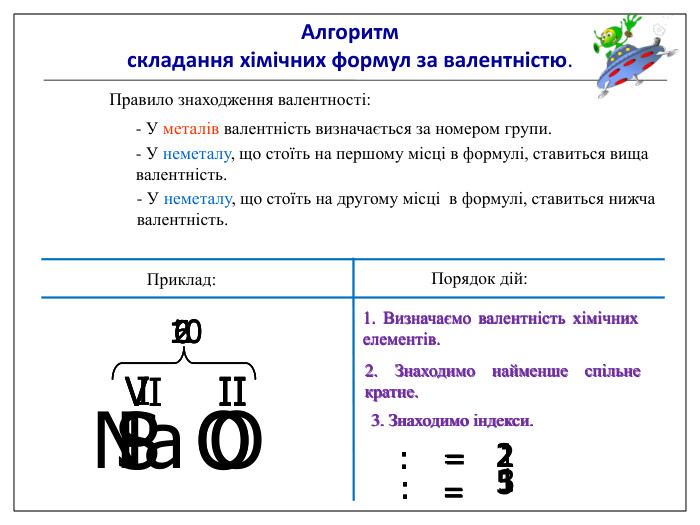
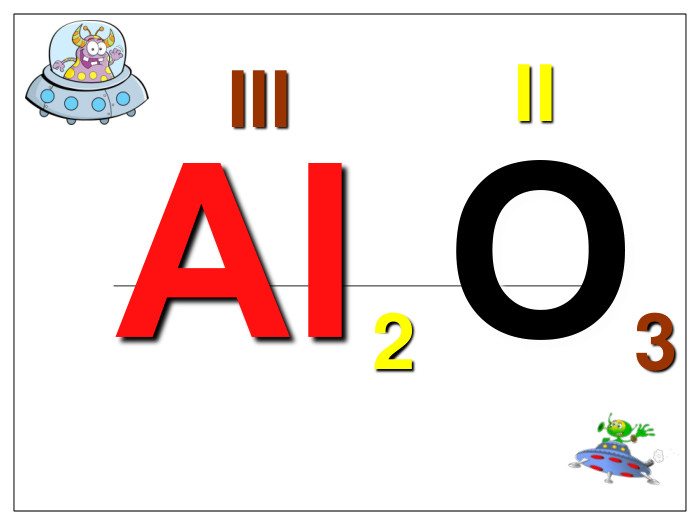
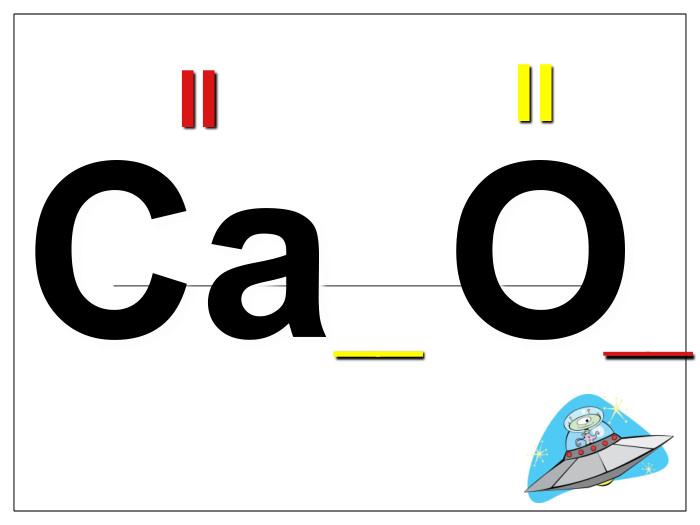
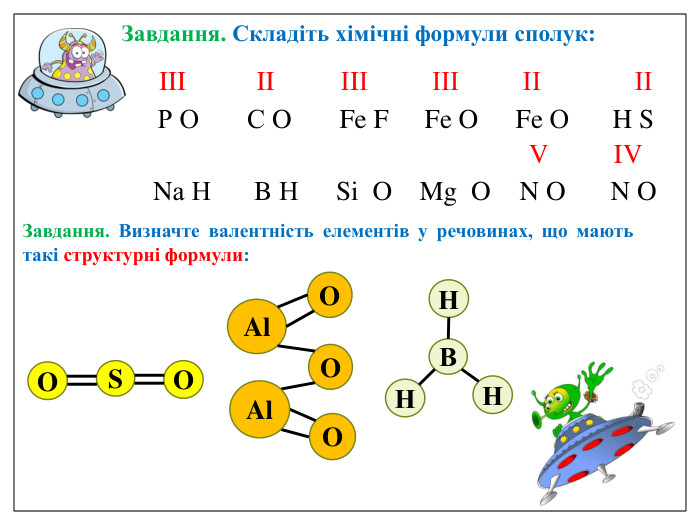
Алгоритм складання хімічних формул за валентністю. Правило знаходження валентності: - У металів валентність визначається за номером групи. - У неметалу, що стоїть на першому місці в формулі, ставиться вища валентність. - У неметалу, що стоїть на другому місці в формулі, ставиться нижча валентність. Na O Приклад: I II 2 Порядок дій: 1. Визначаємо валентність хімічних елементів. 2. Знаходимо найменше спільне кратне. 3. Знаходимо індекси. : 2 I = 2 2 2 : II = 1 1 S O VI II 6 1. Визначаємо валентність хімічних елементів. 2. Знаходимо найменше спільне кратне. 3. Знаходимо індекси. : 6 VI = 1 1 6 : II = 3 3 P O V II 10 1. Визначаємо валентність хімічних елементів. 2. Знаходимо найменше спільне кратне. 3. Знаходимо індекси. : 10 V = 2 2 10 : II = 5 5
Увага! На першому місці записується символ того елемента, який у Періодичній системі розташований зліва або нижче порівняно з іншим. (виключення: метали з Гідрогеном – NaH, СаН2, NH3, РН3). Складаючи хімічні формули бінарних сполук враховуйте порядок написання символів елементів у формулі.
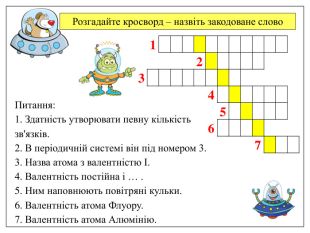
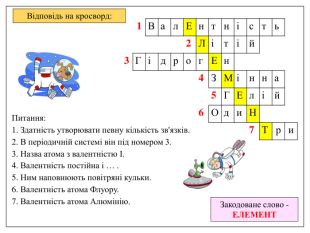
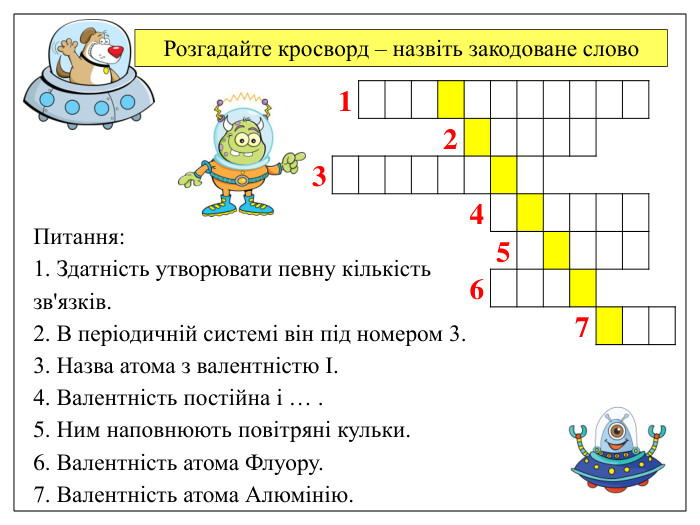
Розгадайте кросворд – назвіть закодоване слово Питання: 1. Здатність утворювати певну кількість зв'язків. 2. В періодичній системі він під номером 3. 3. Назва атома з валентністю І. 4. Валентність постійна і … . 5. Ним наповнюють повітряні кульки. 6. Валентність атома Флуору. 7. Валентність атома Алюмінію.
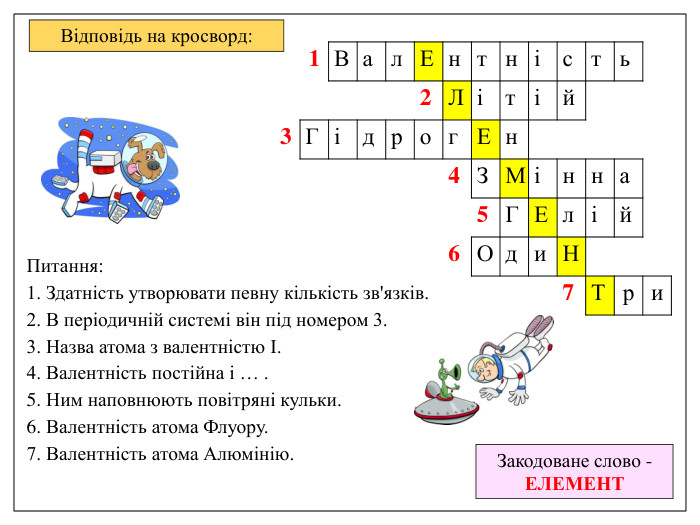
Відповідь на кросворд: Питання: 1. Здатність утворювати певну кількість зв'язків. 2. В періодичній системі він під номером 3. 3. Назва атома з валентністю І. 4. Валентність постійна і … . 5. Ним наповнюють повітряні кульки. 6. Валентність атома Флуору. 7. Валентність атома Алюмінію. Закодоване слово - ЕЛЕМЕНТ


про публікацію авторської розробки
Додати розробку