Презентація " Відкриття періодичної системи Д.І.Менделеєва"
Про матеріал
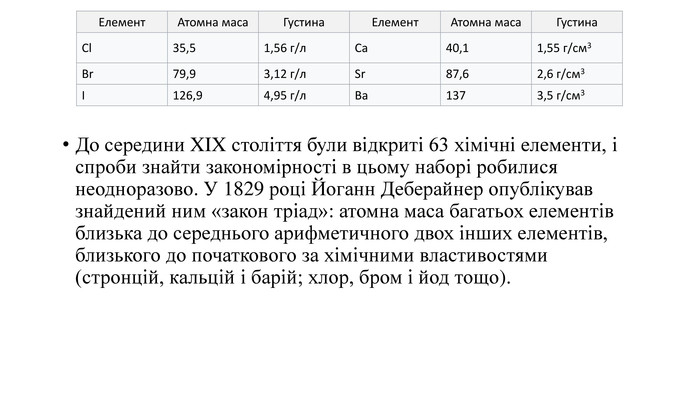
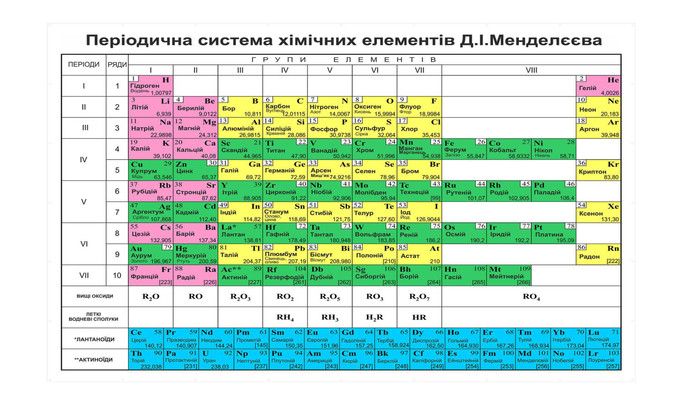
Дана презентація на тему " Відкриття періодичної системи Д.І.Менделеєва" для учнів 7 класів та усіх, хто на уроках хімії розглядає тему про винайдення періодичної системи хімічних елементів. Матеріал розміщено на 13 слайдах. Розглянуто історію винайдення періодичної ситеми. Розглянуто алгоритм характеристики хімічного елемента за місцем розміщення його у періодичній системі. Наведено приклад характеристики елемента - Сульфур. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку