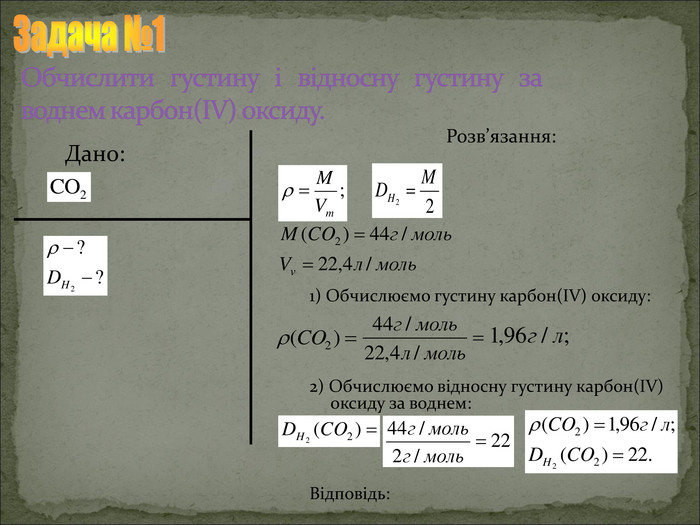
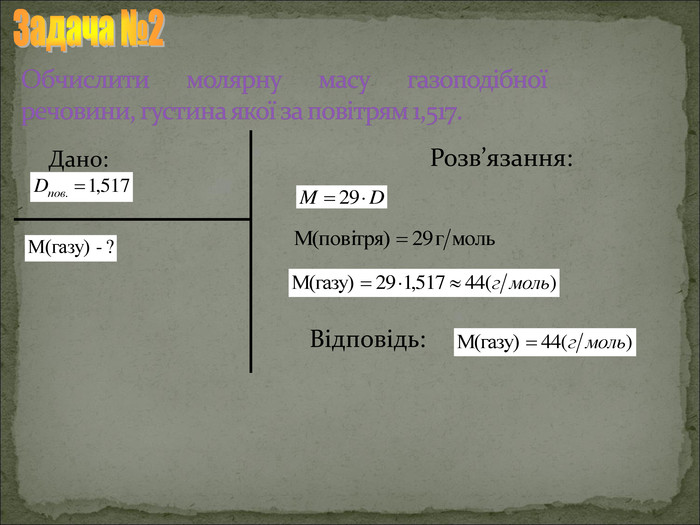
Презентація "Відносна густина газів"
Про матеріал
Презентація допоможе вчителю пояснити учням 7 класу новій тип задач. Пояснення та оформлення запису задач - все це простіше сприймається учнями у супроводі з презентацією.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку