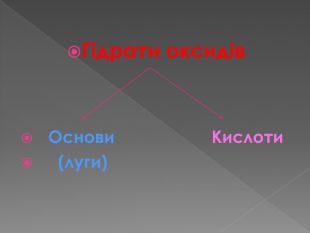
Презентація. Взаємодія води з оксидами
Про матеріал
Презентація призначена для використання на уроках хімії у 7 класі під час вивчення взаємодії води з оксидами. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку