Презентація "Явище електролітичної дисоціації. Дисоціація кислот, лугів та солей уводних розчинах"
Про матеріал
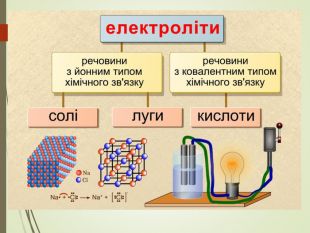
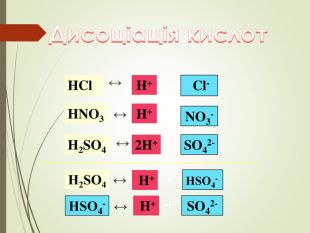
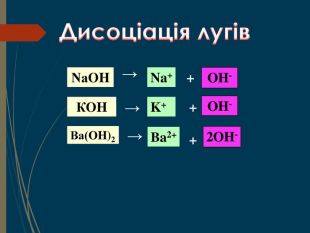
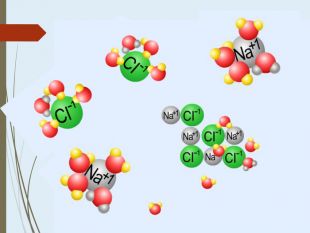
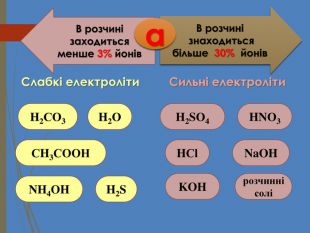
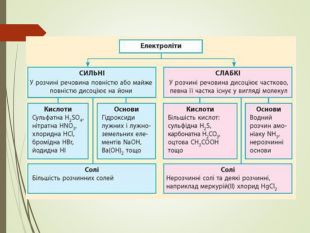
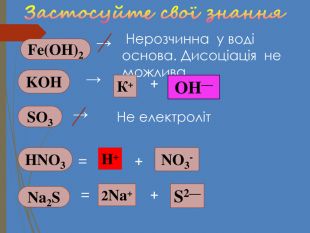
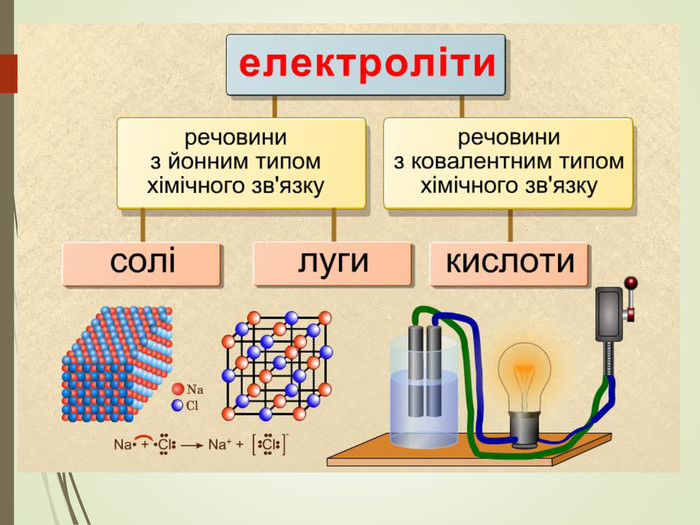
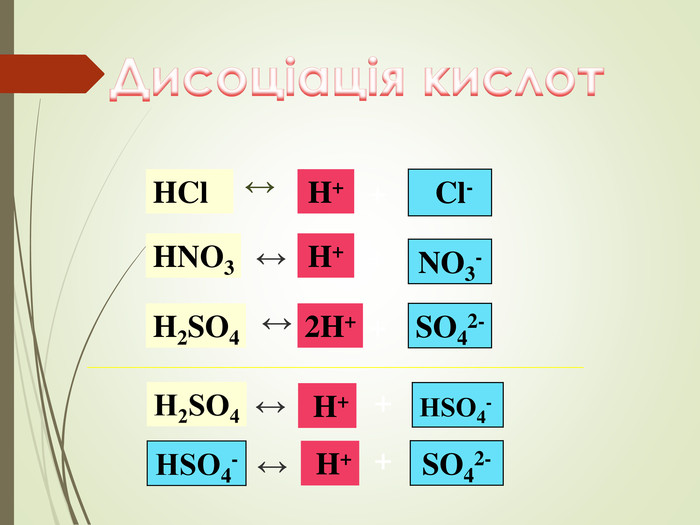
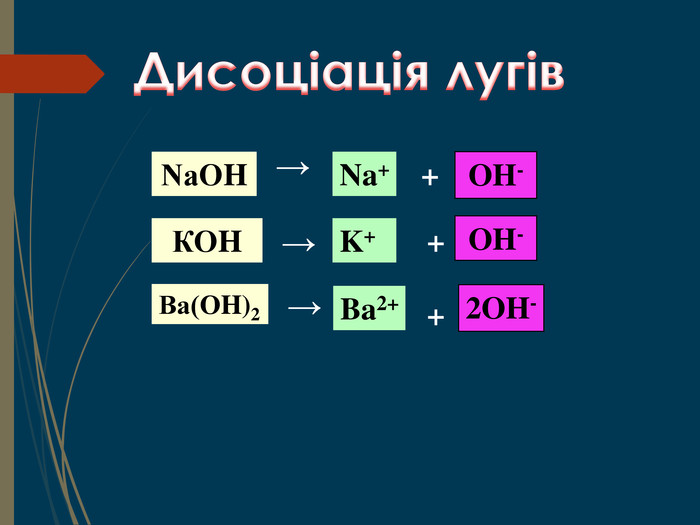
Структуровано основні правила, що застосовують під час написання рівнянь дисоціації кислот, лугів та солей. Перегляд файлу




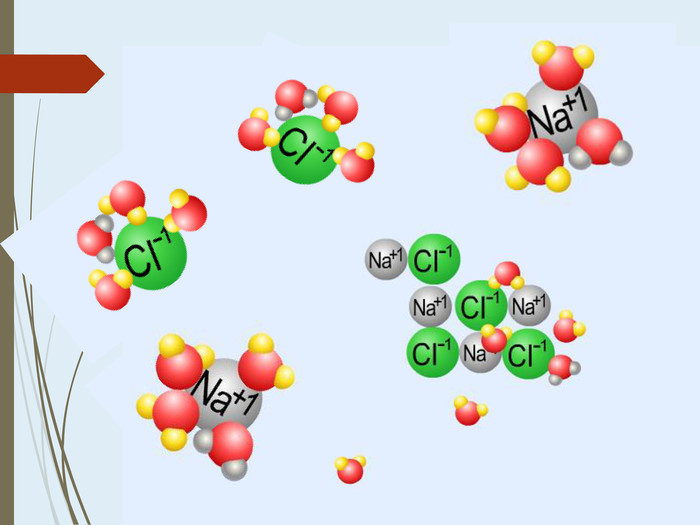
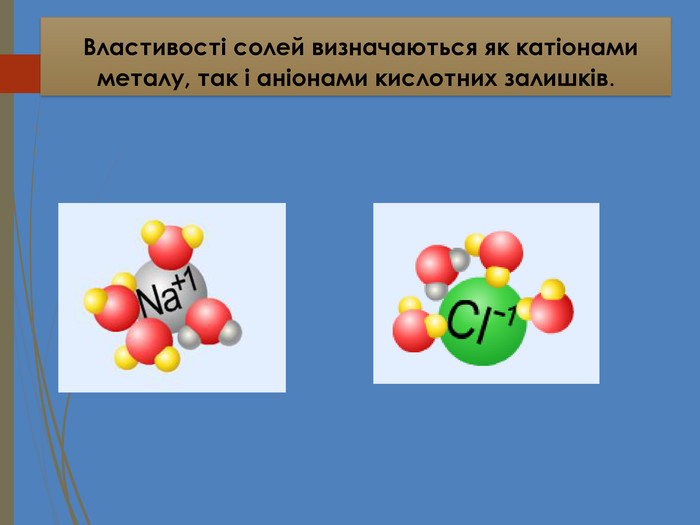

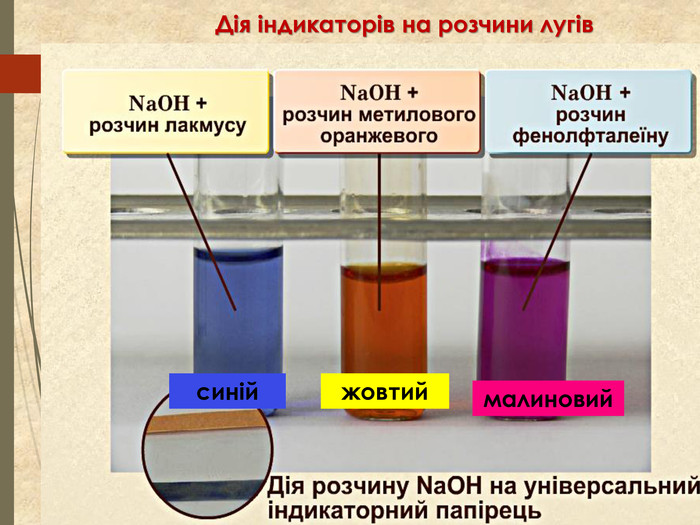



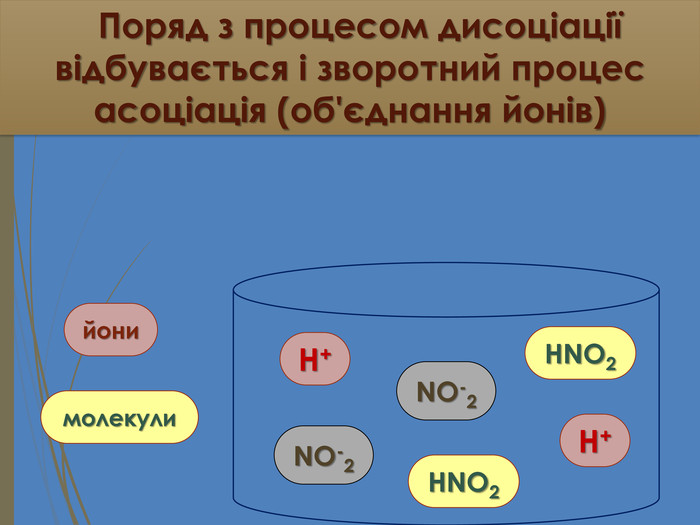
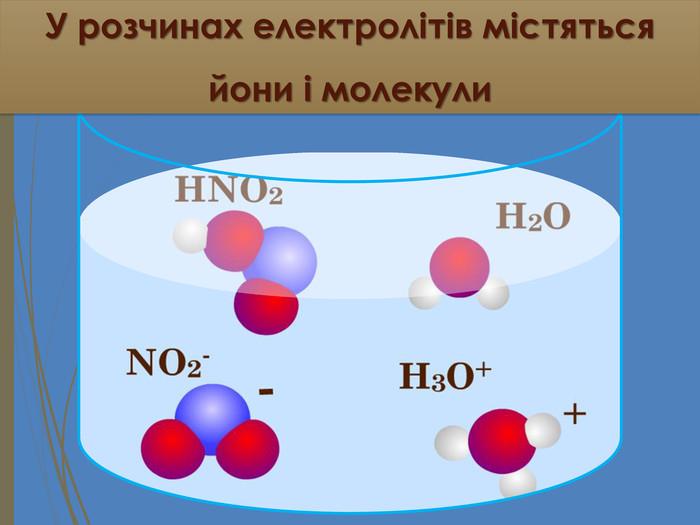
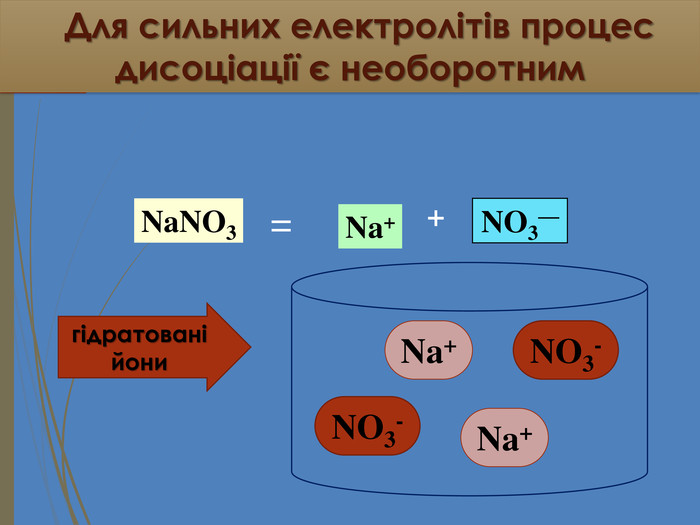
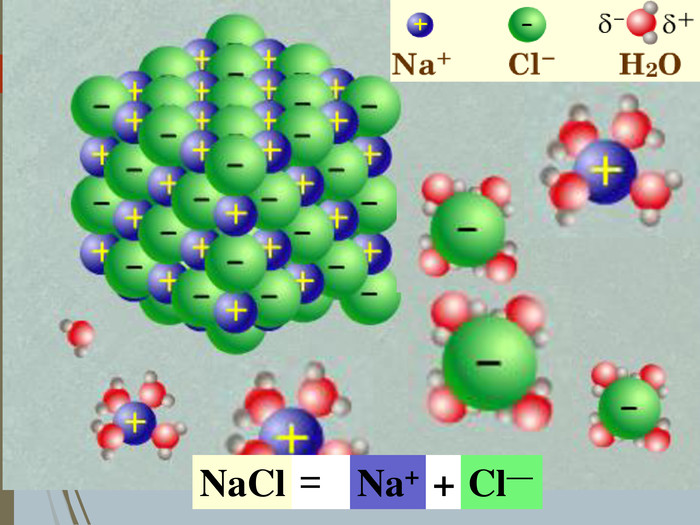
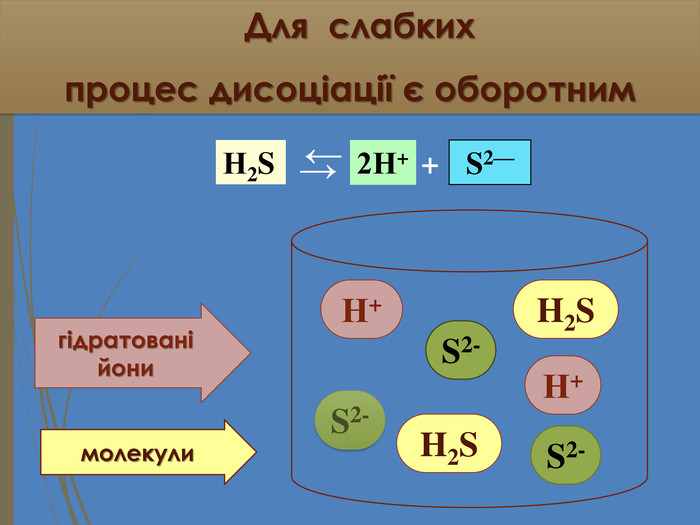
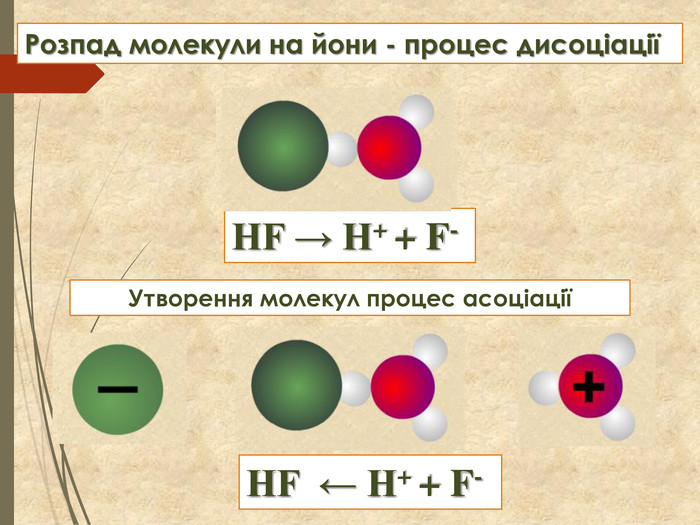

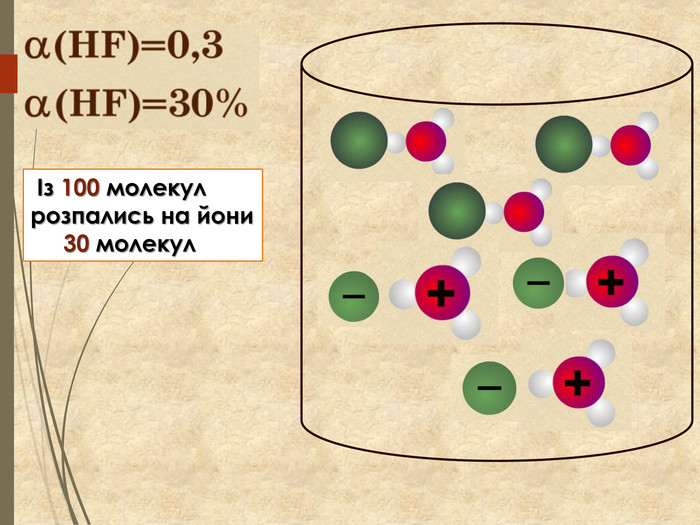
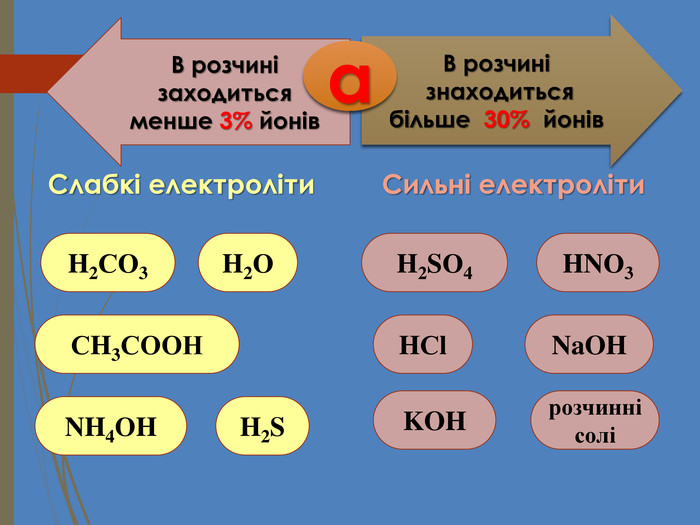
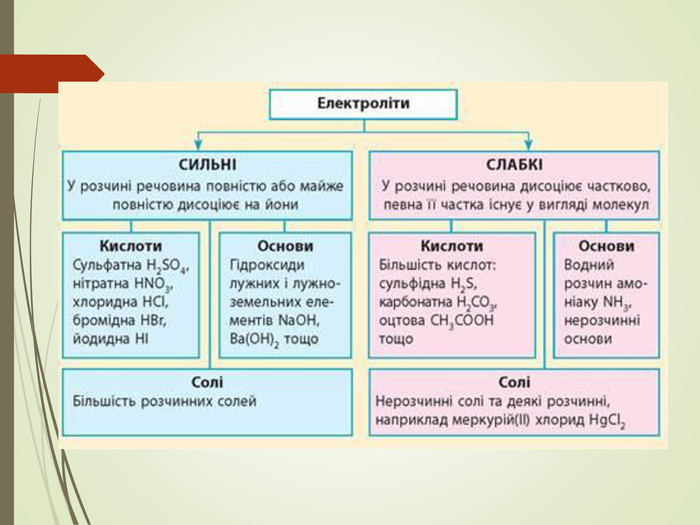

Зміст слайдів
Номер слайду 27
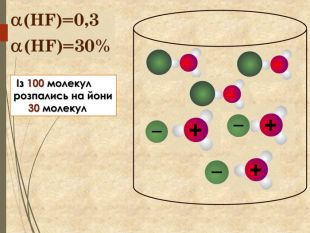
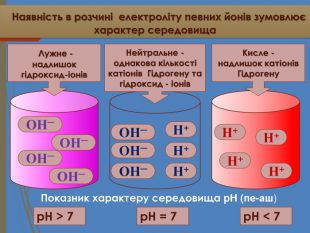
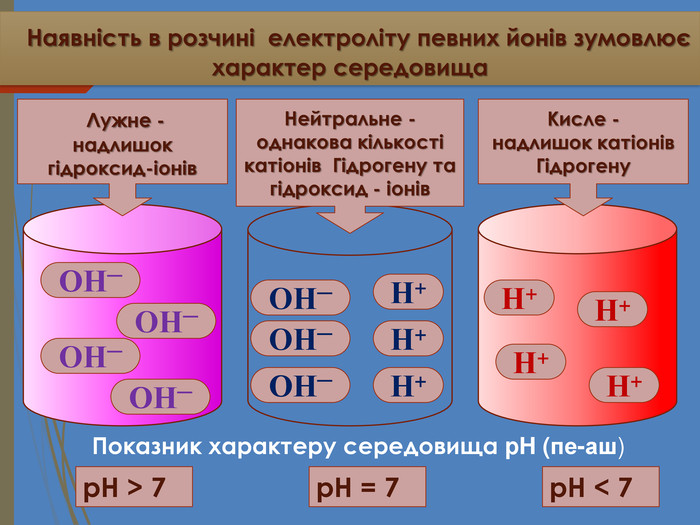
Наявність в розчині електроліту певних йонів зумовлює характер середовища. ОН─ОН─ОН─Н+Н+Н+Н+p. H < 7p. H = 7 ОН─ОН─ОН─Н+Н+Н+ОН─p. H > 7 Показник характеру середовища p. H (пе-аш) Кисле -надлишок катіонів Гідрогену. Нейтральне -однакова кількості катіонів Гідрогену та гідроксид - іонів Лужне -надлишок гідроксид-іонів
Середня оцінка розробки
Структурованість
5.0
Оригінальність викладу
4.5
Відповідність темі
5.0
Загальна:
4.9
Всього відгуків: 2
Оцінки та відгуки
-
 Франчук Мар'яна Віталіївна 11.10.2022 в 22:55Загальна:4.7Структурованість5.0Оригінальність викладу4.0Відповідність темі5.0
Франчук Мар'яна Віталіївна 11.10.2022 в 22:55Загальна:4.7Структурованість5.0Оригінальність викладу4.0Відповідність темі5.0 -
 Воронівська Наталья Гуріївна 28.09.2022 в 20:49Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Воронівська Наталья Гуріївна 28.09.2022 в 20:49Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
pptx
Додав(-ла)
Літковець Світлана
До підручника
Хімія 9 клас (Березан О.В.)
Додано
18 лютого 2021
Переглядів
3489
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
Рекомендовані матеріали
Схожі матеріали