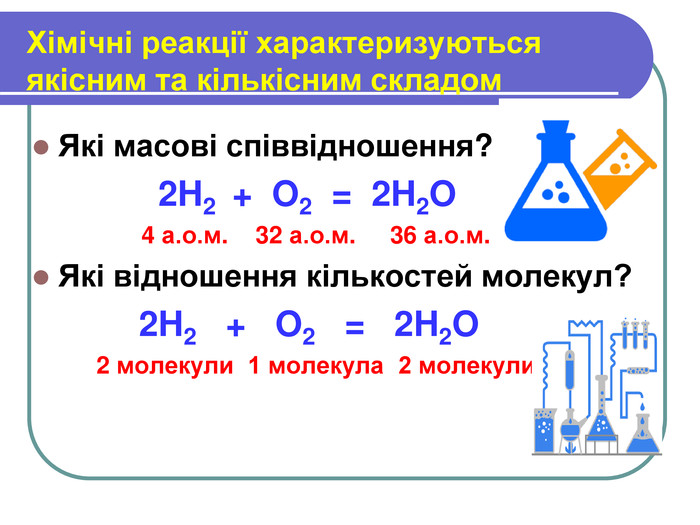
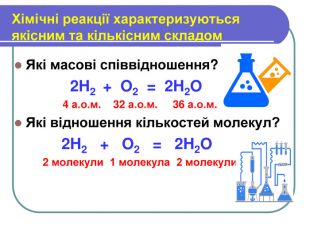
Презентація з хімії на тему " Кількість речовини. Молярна маса. Стала Авогадро" для 8 класу
Про матеріал
Презентація з хімії на тему " Кількість речовини. Молярна маса. Стала Авогадро" для 8 класу. Презентація на уроці слугує доповненням на уроці, як для вчителя, так і для учня. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку