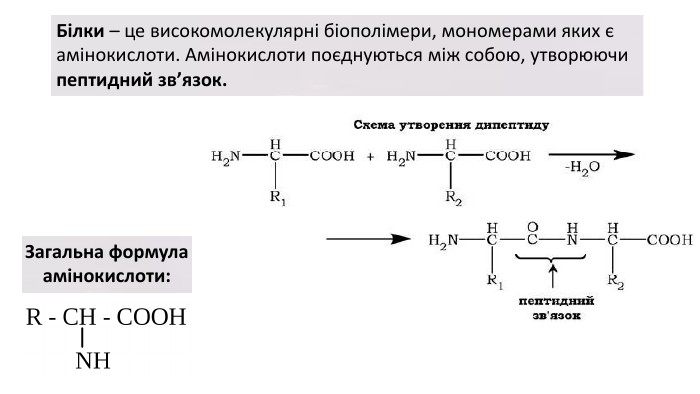
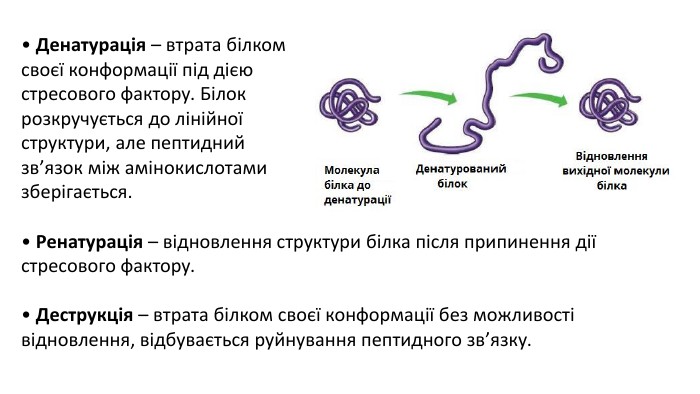
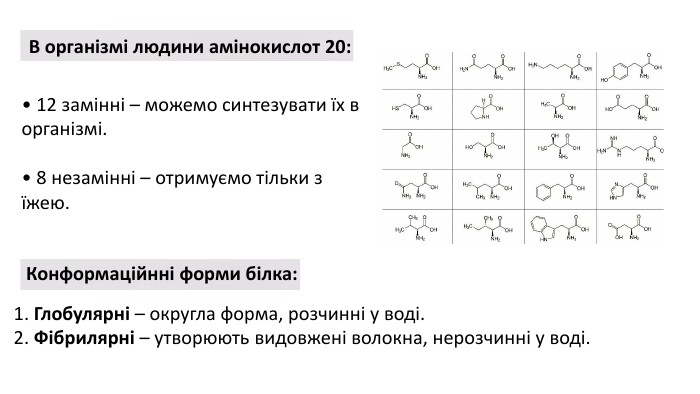
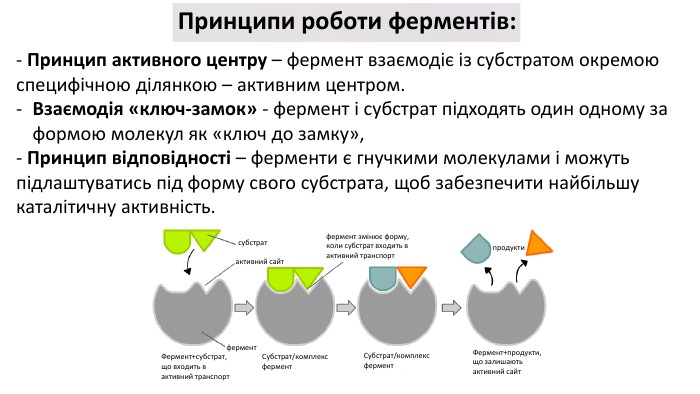
Презентація з теми: "БІЛКИ"
Про матеріал
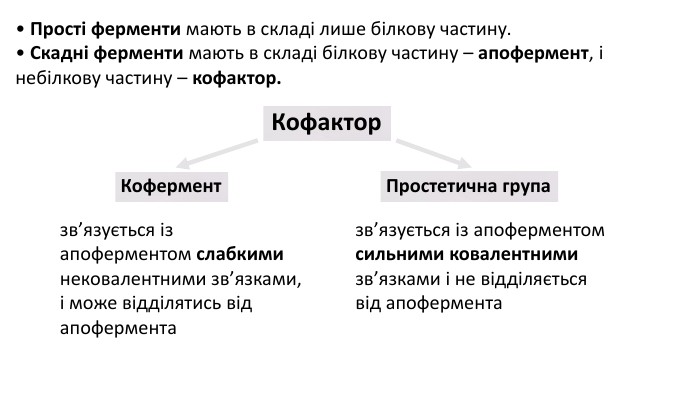
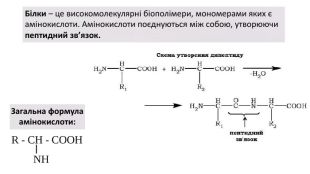
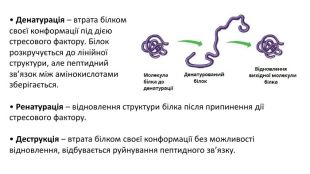
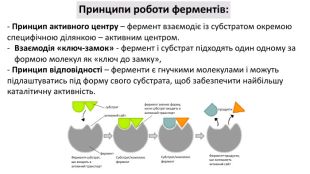
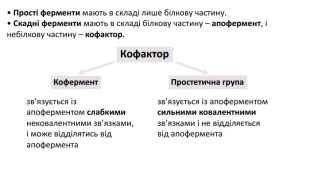
Презентація з біології на тему: Білки - високомолекулярні біополімери, мономерами яких є залишки амінокислоти. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку