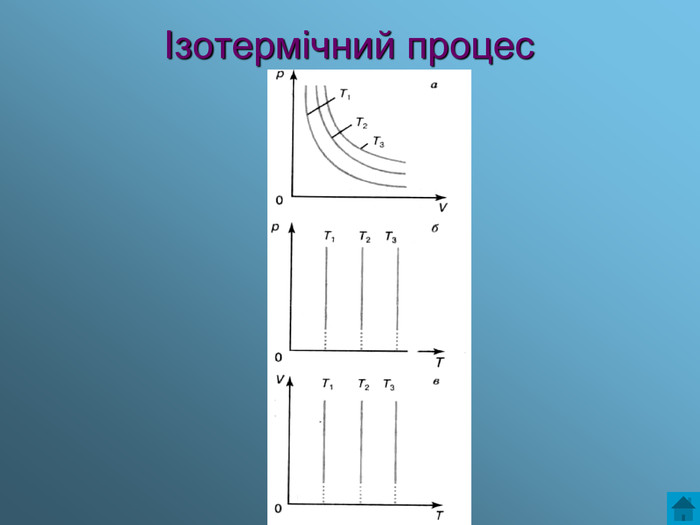
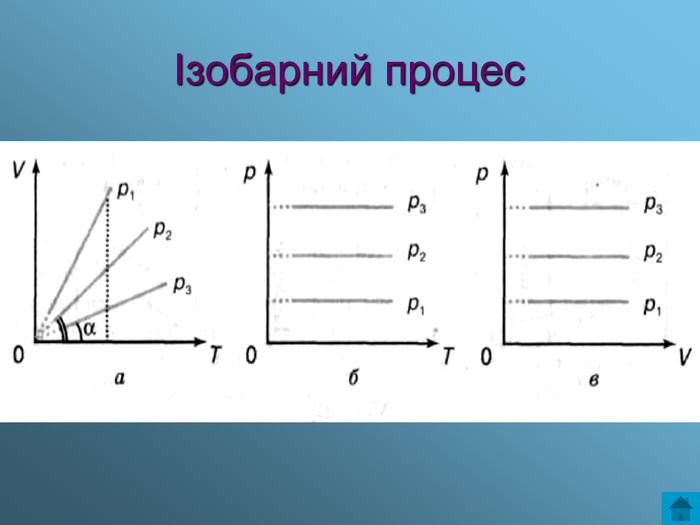
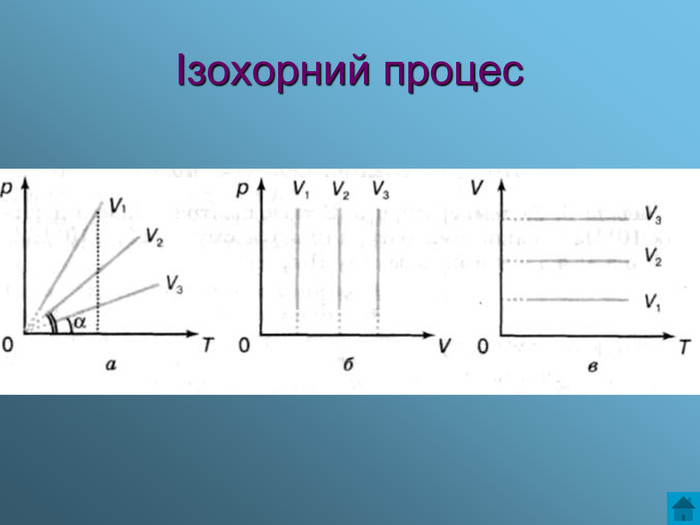
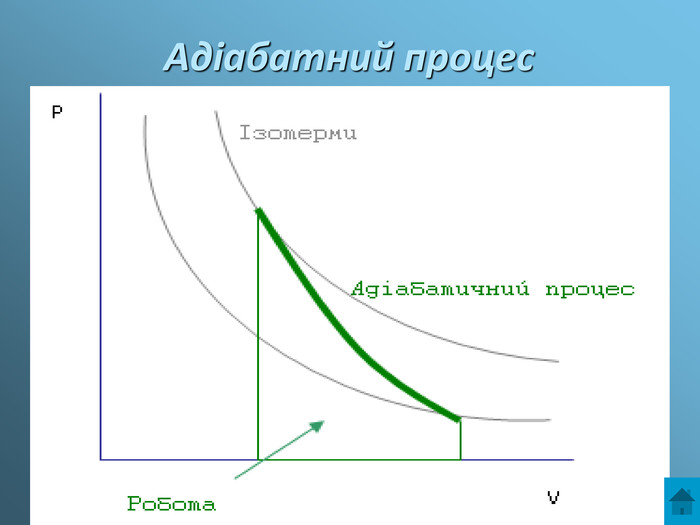
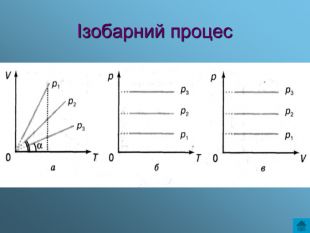
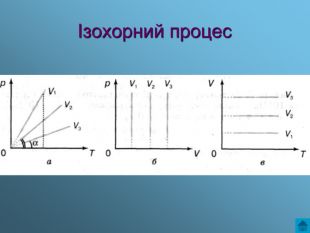
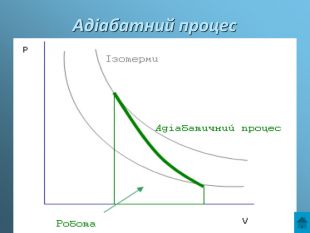
Презентація з теми: Газові закони
Про матеріал
Презентація значно спростить процес проведення занять і допоможе пробудити інтерес студентів до предмета. Перегляд файлу
Зміст слайдів
pptx
До підручника
Фізика (академічний рівень) 10 клас (Бар’яхтар В.Г., Божинова Ф.Я.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку