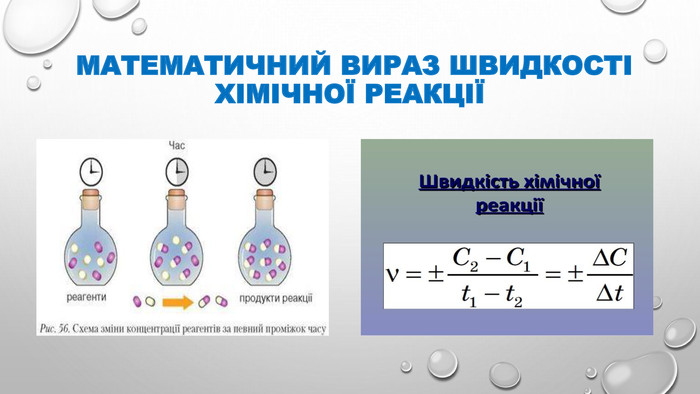
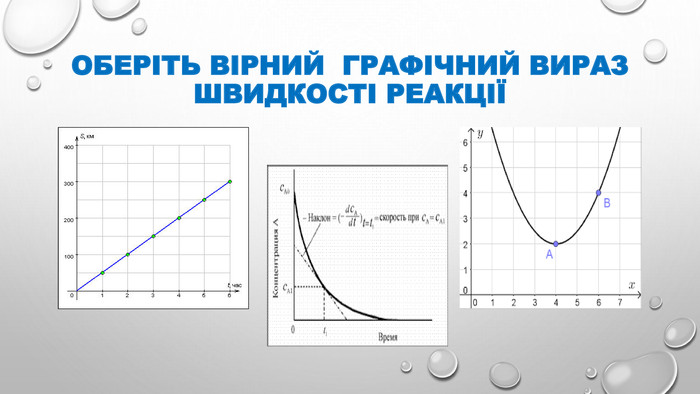
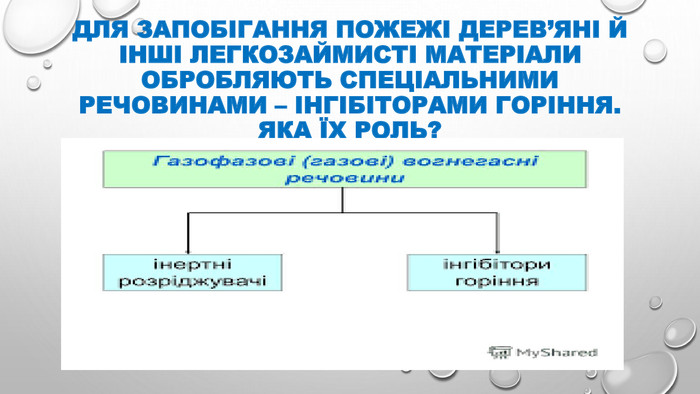
Презентація з теми "Швидкість хімічних реакцій". 9 клас.
Про матеріал
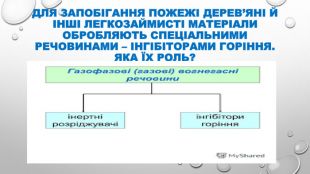
Презентація з теми "Швидкість хімічних реакцій. Залежність швидкості реакцій від різних чинників" містить завдання й наочний матеріал для проведення уроку з однойменної теми ( розробку уроку додано до бібліотеки). Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку