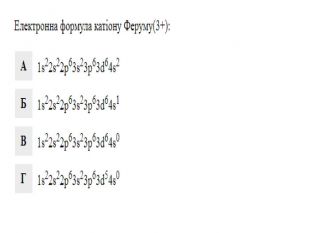Презентація "Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2 і 3 періодів"
Про матеріал
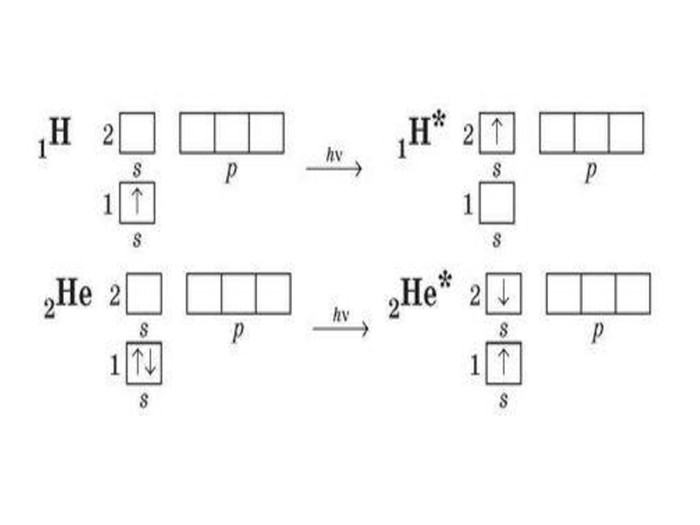
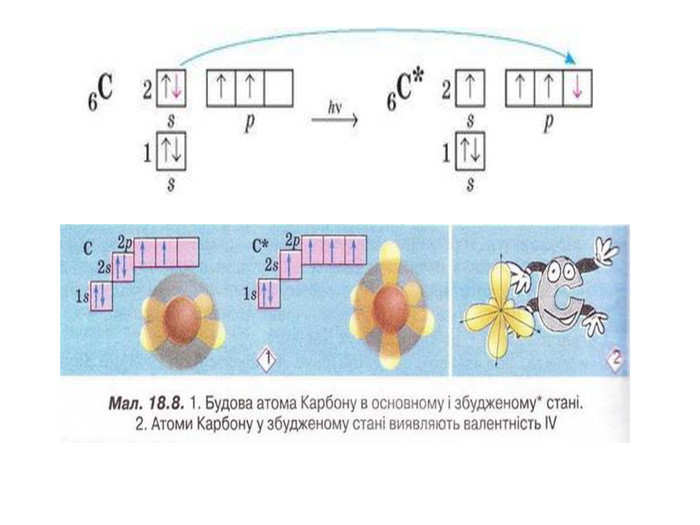
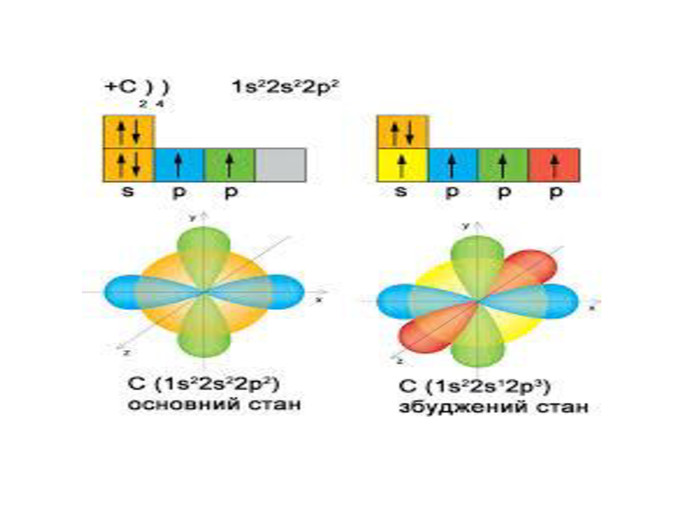
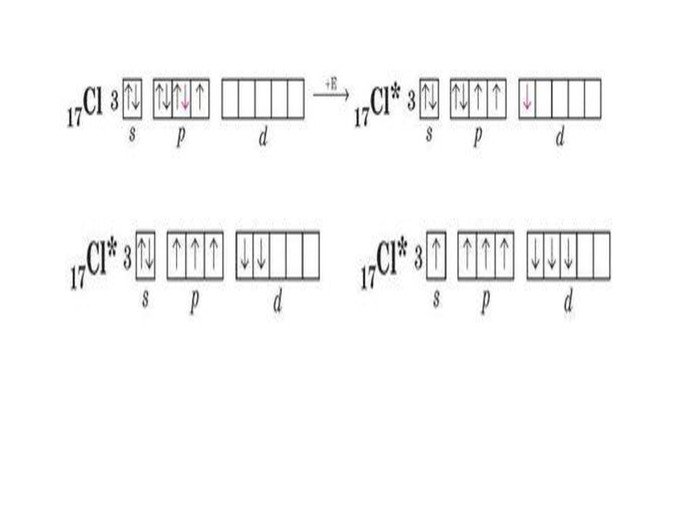
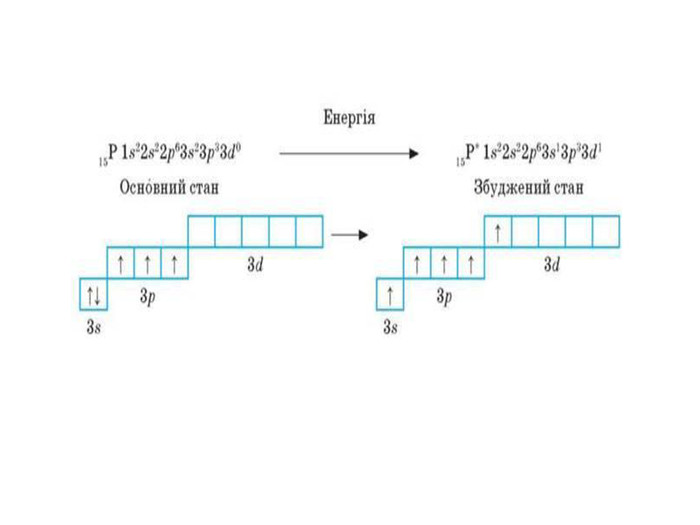
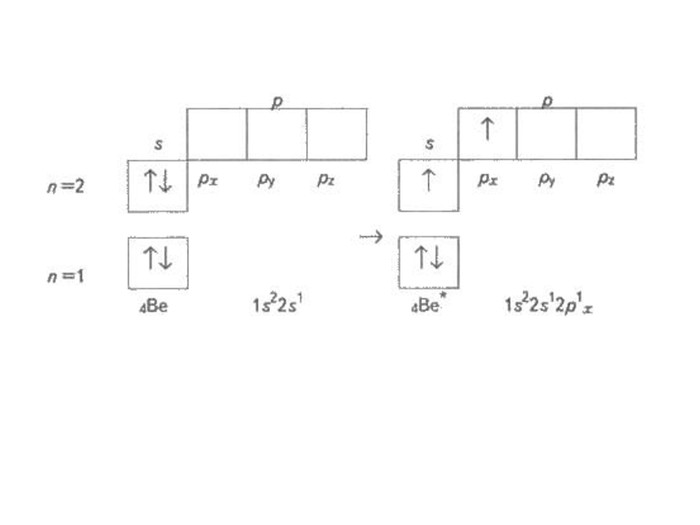
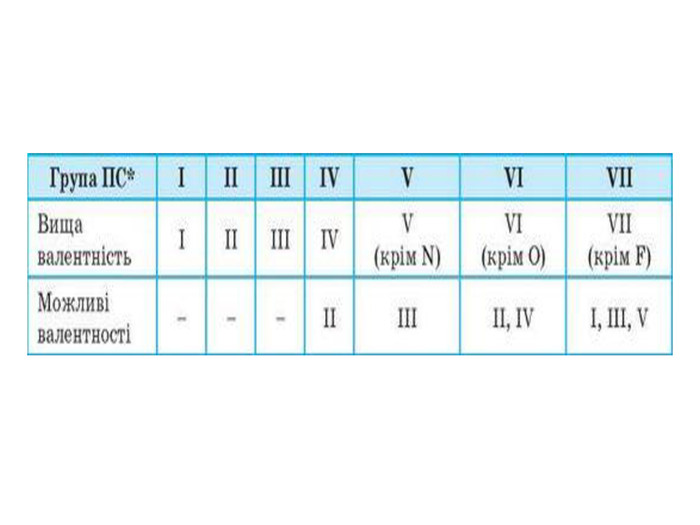
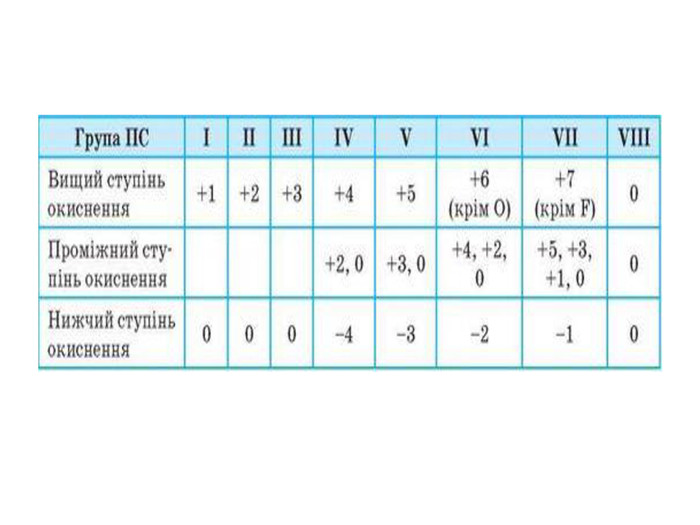
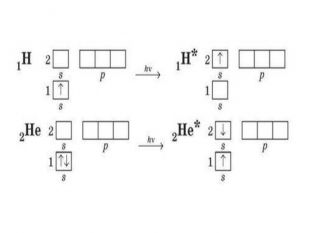
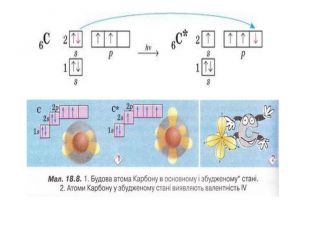
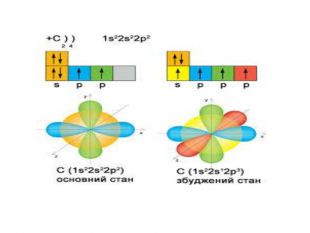
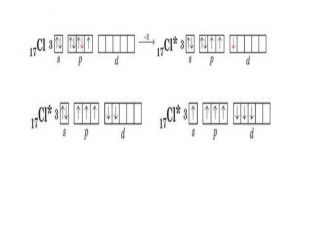
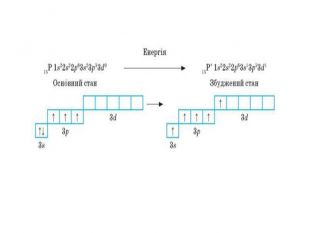
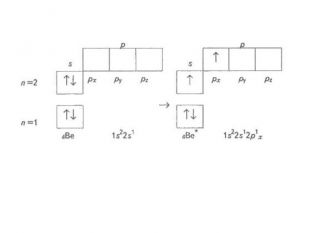
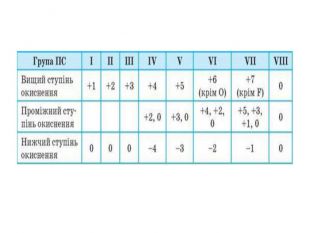
Презентація до уроку в 11 класі "Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2 і 3 періодів" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку