Просторова будова молекули
8 клас
Тема уроку: Просторова будова молекули
Мета уроку: формування знань учнів про хімічний зв'язок; ознайомлення з характеристиками ковалентного зв’язку та механізмом його утворення; розкриття значення поняття гібридизація; ознайомлення із методом валентних зв’язків та методом встановлення просторової будови молекули; розвинення вміння логічно мислити і здатності узагальнювати та наводити приклади, робити висновки та застосовувати теоретичні знання.
Хід уроку.
І Організаційний етап.
Оголошення теми уроку та його мети і задач, плану уроку.
ІІ. Актуалізація опорних знань, мотивація навчальної діяльності.
Питання на обговорення в класі:
- Що таке електронегативність?
- Що таке хімічний зв'язок?
- Які типи хімічних зв’язків Вам відомі? Приклади?
- Що таке ковалентний зв'язок?
- Що таке неполярний та полярний ковалентні зв’язки ?
Тести на картках (для декількох учнів).
- Що таке правило Октета?
- Напишіть електронну та графічну формулу для Na та S?
- Яку валентність може мати Сульфур згідно електронної будови?
- Що таке «збуджений стан»? Наведіть приклади.
- Розташуйте молекули зі збільшенням полярності зв’язку: H2O, NH3, PH3, SO2
- Чому молекула NH3 розчиняється у воді, а молекула CH4 ні?
- Порівняйте температури плавлення NaCl, H2O та Fe? Як природа хімічного зв’язку впливає на температуру плавлення?
- Розташувати молекули по стовпчикам за типом хімічного зв’язку: NaCl, H2SO4, H2O, H2,NH3, NH4Cl,H2O2
|
Ковалентний полярний |
Ковалентний неполярний |
Йонний |
|
|
|
|
ІІІ. Вивчення нового матеріалу.
Постановка проблемного питання.
І. З чим пов’язана просторова будова молекул?
Спочатку необхідно сформувати поняття про механізм утворення ковалентного зв’язку. Під час утворення такого зв’язку відбувається перекриття зовнішніх електронних хмар атомів, що беруть участь в утворенні зв’язку. Таким чином формується так звана спільна електронна пара, яка забезпечує утворення ковалентного зв’язку і належить обом атомам. В залежності від електронегативності елементів, атоми яких утворюють зв’язок, ця пара буде зміщена (сильно, або слабко) в бік більш електронегативного атома. Утворення такого зв’язку є енергетично вигідним, адже забезпечує формальне доповнення електронних оболонок кожного з атомів.
Виникнення спільної електронної пари може проходити за різними механізмами: частіше -за обмінними, а інколи -за донорно-акцепторними. При обмінному механізмі обидва атоми надають по одному електрону і таким чином формують спільну електронну пару. За донорним механізмом одразу два електрони надає один атом (донор), а інший (акцептор) приймає ці електрони на вакантну орбіталь.
Очевидно, що на просторову структуру молекули будуть впливати кількість зв’язків, які утворюють атоми, а також неподілені електронні пари, якщо вони наявні. Оскільки ковалентні зв’язки і спільні електронні пари складаються з від’ємно заряджених електронів, то за рахунок електростатичних сил вони будуть відштовхуватись один від одного.
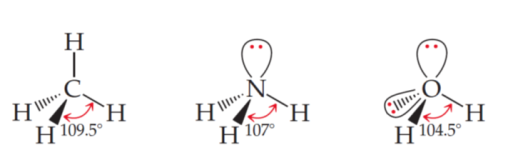
При передбаченні форми молекули зазвичай враховують кількість зв’язків та неподілених електронних пар центрального атому на зовнішньому енергетичному рівні. Неподілені електронні пари є негативно зарядженими, а тому будуть взаємовідштовхуватися від ковалентних зв’язків, розташовуючись у просторі так, щоб відштовхування було мінімальним. Варто зазначити, що відштовхування між зв’язками є дещо меншим ніж, наприклад, між зв’язком та електронною парою. Це пов’язано з більшою делокалізакію електронів, що беруть участь в утворенні зв’язку, адже вони належать одразу двом атомам. На рис. 1 наведені різні сполуки, що мають різну кількість неподілених електронних пар. Так, атом Оксигену має дві неподілені електронні пари, а тому для молекули води характерний найменший кут між зв’язками. В той час для молекули метану, де атом Карбону не має неподілених пар кут між зв’язками буде найбільший.
|
|
|
Рис. 1. Ілюстрація впливу неподілених електронних пар на просторову будову молекули |
Отже, для встановлення просторової будови, будемо користуватись кількістю: зв’язків (А) та неподілених електронних пар (В). Величина, що характеризує форму молекули називається стеричним числом (СЧ) і визначається як сума зв’язків та неподілених електронних пар:
А+В=СЧ.
Можливі форми молекули за кількістю зв’язків та неподілених електронних пар наведені в таблиці 1.
Таблиця 1
|
Кількість спільних електронних пар (А) |
Кількість неподілених електронних пар (В) |
Стеричне число (А+В) |
Геометрія молекули |
|
2 |
0 |
2 |
Лінійна |
|
3 |
0 |
3 |
Трикутник |
|
2 |
1 |
3 |
Кутова |
|
4 |
0 |
4 |
Тетраедер |
|
3 |
1 |
Трикутна |
|
|
2 |
2 |
кутова |
|
|
5 |
0 |
5 |
Тригональна біпіраміда |
|
4 |
1 |
Диформований тетраедер, «гойдалка», дисфеноїд |
|
|
3 |
2 |
Т-подібна |
|
|
2 |
3 |
Лінійна |
|
|
6 |
0 |
6 |
Октаедер |
|
5 |
1 |
Квадратна біпіраміда |
|
|
4 |
2 |
Квадратна |
|
|
7 |
0 |
7 |
Пентагональна біпіраміда |
|
7 |
1 |
Квадратна біпіраміда |
|
|
7 |
2 |
Квадратна |
Розглянемо деякі приклади визначення просторової структури молекул:
Приклад 1 Молекула H2O
A=2, B=2
A+B=4 (тетраедер)
Положення атомів
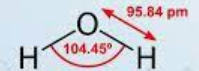
Форма: кутова
Приклад 2 Молекула SO2
A+B=3 (плоский трикутник)
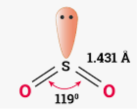
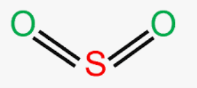
Форма : кутова
Приклад 3 Молекула MgCl2
A=2, B=0
A+B=2 (лінійна)
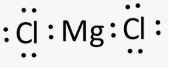
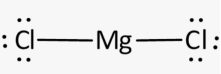
Форма : лінійна
ІІ. Також для пояснення просторової будови молекули необхідно ввести поняття про гібридизацію. Так що таке гібридизація?
Гібридизація- явище змішування атомних орбіталей визначеного атома із утворенням такого ж числа нових гібридних орбіталей, яким притаманна однакова форма та виражена просторова спрямованість.
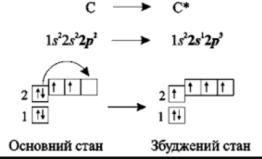
Класичним прикладом явища гібридизації є утворення С-Н зв’язків у молекулі метану. Розглянемо більш детально цей процес. Атом Карбону переходить у збуджений стан
(рис. 2):
|
|
|
Рис. 2. Електронні конфігурації атома Карбону в основному та збудженому станах. |
Як можна помітити на рис. 2 в збудженому стані у атома Карбону на чотирьох орбіталях знаходиться по одному електрону. Під час гібридизації з них утворюється 4 нових однакових гібридних орбіталі, що містять по одному електрону. Оскільки в такому процесі беруть участь одна s і три p орбіталі, то атом Карбону буде sp3 гібридизованим. Також можлива гібридазація ще за участі d орбіталей, або ж, навпаки, лише за участі однієї s і однієї p орбіталей і тд. Очевидно, що тип гібридизації центрального атома буде визначати просторову будову молекули (табл. 2).
Таблиця 2.
|
Тип гібридизації |
Форма молекули |
Приклад |
|
Sp |
Лінійна |
HCl |
|
Sp2 |
Трикутна |
SO3 |
|
Sp3 |
тетраедрична |
CH4 |
|
Sp3d |
Тригональна біпіраміда |
PCl5 |
Розглянемо приклади визначення просторової форми молекул, враховуючи їх гібридизацію.
Приклад 4 молекула ClF3
A=3, B=2
A+B=5 (тригональна біпіраміда)
Cl:… 3S23P5→….3S23P43d1 отже Гібридизація Cl:sp3d1
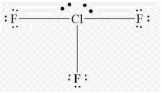
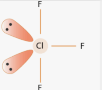
Форма: Т -подібна
Приклад 5 Молекула NH3
A=3, B=1
A+B=4 (тетраедер)
N: 2S22P3→ отже Гібридизація N:sp3
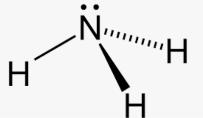
Форма: тригональна піраміда
Приклад 6 Молекула AlCl3
A=3, B=0
A+B=3 (плоский трикутник)
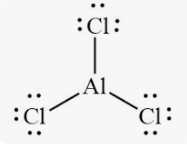
Форма : трикутник
Приклад 7 Молекула XeF4
A=4, B=2 A+B=6 (октаедер)
Xe:…5S25P6→…5S25P45d2 отже Гібридизація Xe: sp3d2
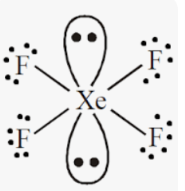
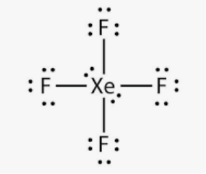
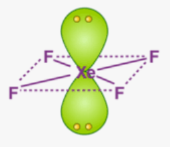
Форма : Квадрат
Приклад 8 молекула SF4
A=4, B=1 A+B=5 (тригональна бипіраміда)
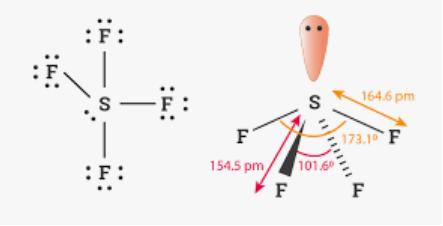
Форма: диформований тетраедер
Приклад 9 Молекула CH4
A=4, B=o A+B=4 (тетраедер)
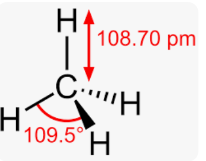
Форма : тетраедер
Приклад 10 молекула IF5
A=5, B=1 A+B=6 (октаедер)
I:…5S25P5→…5S25P35d2 отже Гібридизація I: sp3d2
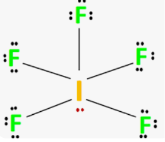
Форма : квадратна піраміда
Приклад 11 молекула PF5
A=5, B=0 A+B=5 (тригональна біпираміда)
P:…3S23P3→…3S13P33d1 отже Гібридизація P: sp3d
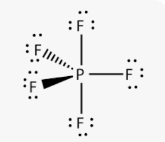
Форма: тригональна бипираміда
Приклад 12 Молекула SCL6
A=6, B=0 A+B=6 (октаедер)
S:…3S23P4→…3S13P33d2 отже Гібридизація S: sp3d2
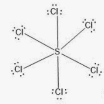
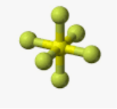
Форма : октаедер
ІІІ. Що таке σ-зв’язок та π-зв’язки і як вони впливають на просторову будову молекули?
Сигма-зв’язок (σ-зв’язок) — простий (одинарний) ковалентний зв’язок, що утворюється перекриванням електронних орбіталей по лінії, яка з’єднує атоми. Зв’язок характеризується осьовою симетрією:
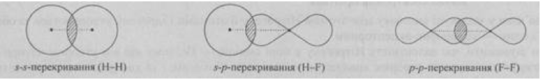
В утворенні σ-зв’язку можуть брати участь як звичайні, так і гібридизовані орбіталі.
2. Пі-зв’язок (π-зв’язок) -ковалентний зв’язок, що утворюється перекриванням електронних орбіталей які розміщені по різні боки від площини, яка з’єднує центри атомів.
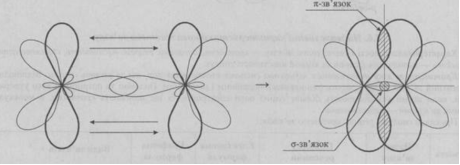
При утворенні π-зв’язків ускладнюється обертання фрагментів молекул навколо цього зв’язку, а також зменшується відстань між атомами, що поєднані цим типом зв’язку. І навпаки для σ-зв’язку характерна відсутність ускладнень при обертанні, а також більша відстань між атомами. Для порівняння С-С – 0,154 нм (лише σ-зв’язок), С=С – 0,134 нм (σ- і π-зв’язок), а С≡С – 0,120 нм (σ- і два π-зв’язки).
Узагальнення та систематизація знань.
- Як ви вважаєте яку просторову будову мають H2S, SO2,OF2,NCL3, BCl3?
- Який тип гібридизації центрального атома в молекулах NH3, PH3, BH3?
- Скільки σ- та π-зв’язків в молекулі?
4.Яка просторова будова правильна?
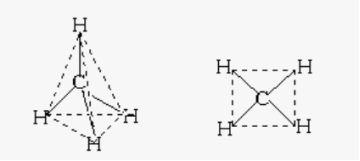
Підведення підсумків уроку.
V. Домашнє завдання:
1. Виконати індивідуальні задачі на картках.
Задача
- Покажіть розподілення валентних електронів по орбіталям для кожного атому в розглянутій молекулі;
- Визначити механізм утворення зв’язку;
- Визначити полярність зв’язку;
- Вкажіть чи має місце гібридизація;
- Покажіть геометричну структуру молекули
|
Номер варіанту |
задача |
|
1 |
H2S, TeF6, Li2, SiC |
|
2 |
GeH4, AsH3, HCl, LiH |
|
3 |
F2, LiCl, HBr, H2Te |
|
4 |
HF, AsF5, PF5, SnH4 |
Література
1 Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. 17-е изд., перераб. и доп. - М.: 2020
2 Березан О. Хімія. Довідник школяра Підручники і посібники, 2021.- 560 с
3https://elearning.sumdu.edu.ua/free_content/lectured:c63732c3bf9b7070c82625f128c7980998d6c700/latest/39743/index.html
4. Ахметов Н.С. Общая и неорганическая химия. Учеб. для Вузов. - 4-е изд., испр. - М.: Высшая школа, 2001. - 743 с


про публікацію авторської розробки
Додати розробку