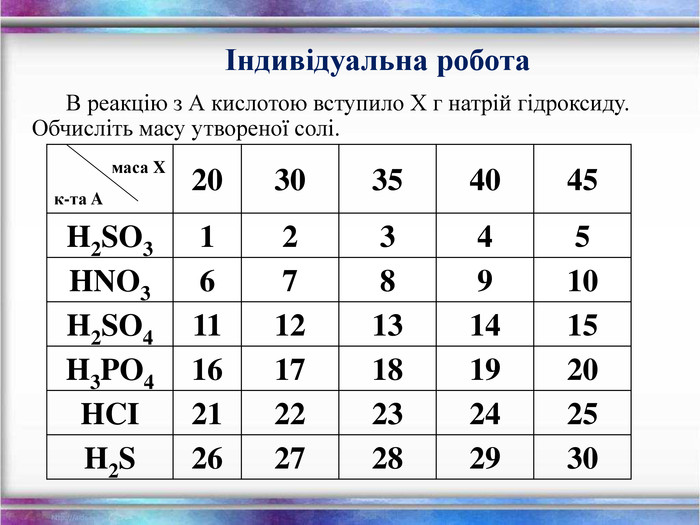
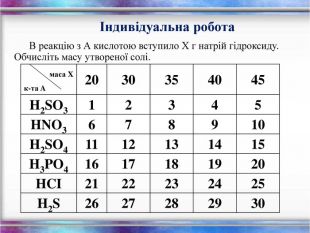
Розрахунки за рівнянянями маси, об'єму, кількості речовини.
Про матеріал
Розв'язування розрахункових задач на знаходження маси, об'єму, кількості речовини. Алгоритм розв'язку задач. Способи рішення. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку








![Для складання пропорції за рівнянням хімічної реакції варто використовувати такі співвідношення:nкоефіцієнт= m коефіцієнт •M = V коефіцієнт • VM n ─ кількість речовини, [моль];m ─ маса речовини, [г];М ─ молярна маса речовини, [г/моль];V ─ об’єм речовини, [л];VМ ─ молярний об’єм речовини, [л/моль], VМ = 22,4 л/моль (за н. у.) для газів Для складання пропорції за рівнянням хімічної реакції варто використовувати такі співвідношення:nкоефіцієнт= m коефіцієнт •M = V коефіцієнт • VM n ─ кількість речовини, [моль];m ─ маса речовини, [г];М ─ молярна маса речовини, [г/моль];V ─ об’єм речовини, [л];VМ ─ молярний об’єм речовини, [л/моль], VМ = 22,4 л/моль (за н. у.) для газів](/uploads/files/90527/238767/258166_images/8.jpg)