Розробка уроку на тему «Молярна маса»
Конспект уроку 4.
Тема: Молярна маса
Мета: формувати поняття «молярна маса», розкрити різницю між поняттями «молярна маса» та «відносна молекулярна маса», формувати вміння робити розрахунки із застосуванням понять «кількість речовини», «молярна маса».
Обладнання: роздатковий матеріал,
Тип уроку: вивчення нового матеріалу
Форми роботи: «Хімічна розминка», робота в парах, бесіда, фронтальна робота
Хід уроку:
І. Організація класу
ІІ. Оголошення теми і мети уроку
ІІІ. Актуалізація опорних знань
Прийом «Хімічна розминка» по основним поняттям попередніх уроків
- Відносна атомна маса
- Відносна молекулярна маса
- Кількість речовини
- Стала Авогадро
- Обчислення відносної молекулярної маси речовини
- Обчислення кількості речовини за відомою кількістю молекул
- Обчислення кількості молекул за відомою кількістю речовини
Робота в парах:
- Обчислити відносні молекулярні маси алюміній оксиду, кальцій ортофосфату (Са3(РО4)2).
IV. Мотивація навчальної діяльності
Проблема: Як пов’язати кількість речовини і масу?
V. Вивчення нового матеріалу.
- Ми вже знаємо, що 1 моль любої речовини містить стале число структурних частинок, але кожна з
них має свою масу. Тому маса 1 моль – це молярна маса.
Молярна маса – маса 1 моль речовини.
- Значення молярної маси речовини чисельно співпадає зі значенням відносної молекулярної маси.
М (речовини) = Mr (речовини)
- Одиниці вимірювання молярної маси речовини:
[М (речовини)] = г/моль
- Молярна маса пов’язана з кількістю речовини
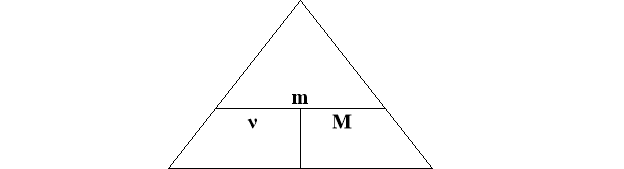
![]() ↔
↔ ![]() ↔
↔ ![]()
- Наводиться приклад розв’язування задачі із застосуванням даних формул:
Обчислити кількість речовини води масою 3,6 г.
Аналіз задачі: Що відомо? Що знайти? Як це зробити?
|
Дано: m (Н2О) = 3,6 г
|
Розв’язання: |
M(Н2О) = Mr (Н2О) Mr (Н2О) = 2·Ar (H) + Ar (O) = 2·1 + 16 = 18 M(Н2О) = 18 г/моль
|
|
|
ν(Н2О) − ? |
Відповідь: ν(Н2О) = 0,2 моль |
VІ. Закріплення вивченого матеріалу
Розв’язування задач. Учням пропонується роздатковий матеріал із переліком задач. Одна задача розв’язується учнем біля дошки.
Робота в парах. Розв’язування задач.
Задачі:
- Обчислити масу ферум (ІІ) оксиду кількістю речовини 0,2 моль.
- Обчислити кількість речовини вуглекислого газу масою 1,1 г.
- Обчислити кількість речовини ферум (ІІІ) сульфату (Fe2(SO4)3) масою 8 г.
- Обчислити кількість молекул, що містяться у воді масою 7,2 г.
VІІ. Підведення підсумків уроку
VІІІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку
