Розробка уроку «Швидкість хімічної реакції, залежність швидкості реакції від різних чинників».
Урок-дослідження у 9 класі. Мета уроку: cформувати уявлення про швидкість хімічної реакції, її залежність від різних чинників, поглибити знання про каталізатори та їх вплив на швидкість реакції, розвивати вміння аналізувати інформацію, порівнювати, класифікувати, формулювати узагальнюючі висновки, застосовувати набуті знання на практиці та оцінювати результати виконаних дій, використовувати суб'єктивний досвід учнів, уміння висловлювати судження про роль хімічних процесів в природі та побуті, допомогти вихованню самостійності, співробітництва, здатності до взаємодопомоги, уважність, бережливе ставлення до хімічних реагентів і свого здоров'я.
9 клас
Тема уроку: «Швидкість хімічної реакції, залежність швидкості реакції від різних чинників».
Мета: cформувати уявлення про швидкість хімічної реакції, її залежність від різних чинників, поглибити знання про каталізатори та їх вплив на швидкість реакції, розвивати вміння аналізувати інформацію, порівнювати, класифікувати, формулювати узагальнюючі висновки, застосовувати набуті знання на практиці та оцінювати результати виконаних дій, використовувати суб’єктивний досвід учнів, уміння висловлювати судження про роль хімічних процесів в природі та побуті, допомогти вихованню самостійності, співробітництва, здатності до взаємодопомоги, уважність, бережливе ставлення до хімічних реагентів і свого здоров’я.
Тип уроку: урок вивчення нового матеріалу.
Форма уроку: урок-дослідження.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва, таблиця електронегативностей хімічних елементів; штатив з пробірками; нагрівальні прилади хімічні склянки і колби.
Нові поняття і терміни: швидкість хімічної реакції, інгібітори, природа речовин, агрегатний стан, ступінь подрібнення, площа зіткнення, концентрація, каталізатор.
Хід уроку
- Організаційний момент.
- Актуалізація і корекція опорних знань учнів.
Епіграф до уроку: «Єдиний шлях до знань – діяльність» ( Бернард Шоу)
Учитель: Діти, на минулих уроках ми розглянули класифікацію хімічних реакцій за різними ознаками давайте проведемо гру:
Гра «Вірю-не вірю»
- Повідомлення теми, мети, завдань уроку і мотивація навчальної діяльності.
Питання до класу:
- Чим відрізняється черепаха від гепарда?
- Чим відрізняється лелека від реактивного літака?
- Пригадайте, чим відрізняється повільне окиснення від горіння та вибуху?
Повідомляючи тему уроку наголошуємо, що на цьому уроці ми зможемо:
- робити висновки про вплив різних чинників на швидкість хімічних реакцій;
- пояснити, який спосіб зберігання харчових продуктів доцільніший.
Та поміркуємо над словами: «Є тільки дві форми життя: гниття і горіння. Боягузи та жадібні оберуть першу, мужні та щедрі – другу.»
У ваших путівниках є таблиця заповніть першу колонку:
|
Що я знаю? |
Про що дізнався? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пропонуємо учням заповнити ліву частину таблиці.( Учні називають, вчитель записує на дошці). Далі говоримо, що наприкінці уроку дізнаємося, чи правильні твердження ми записали і що нове ми можемо дописати в праву частину таблиці.
- Сприймання і первинне усвідомлення нового матеріалу, осмислення зв`язків і відношень в об`єктах вивчення.
Чому одні хімічні реакції відбуваються миттєво, а інші тривають століттями? Відповіді на це запитання важливо знати для того, щоб керувати швидкістю хімічних перетворень, прискорювати корисні й уповільнювати шкідливі процеси.
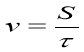 Запитуємо, як позначається швидкість і чому вона дорівнює з точки зору фізика.
Запитуємо, як позначається швидкість і чому вона дорівнює з точки зору фізика.
Проблемне питання: Що відбувається під час хімічної реакції?
Щоб розпочалася хімічна реакція, потрібен контакт між частинками реагентів.
Під час хімічної реакції частинки речовини рухаються і зустрічаються . Чим частіше зустрічаються частинки, тим більше утворюються нових частинок і тим швидше відбувається реакція.
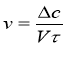 Швидкість хімічної реакції визначається зміною концентрації речовин за одиницю часу.
Швидкість хімічної реакції визначається зміною концентрації речовин за одиницю часу.
Зараз ми спробуємо подорожувати у хімічну лабораторію і ви практично під моїм керівництвом будемо досліджувати хімічні реакції, але спочатку пригадаємо правила техніки безпеки під час роботи з обладнанням та реактивами
Техніка безпеки- це не жарт!
Правила поводження пам’ятати варто
Під час лабораторної роботи
І в побуті, щоб не було турботи, -
Як працювати з кислотою,
Штативом, склом та лугом…
І хімія тоді завжди
Буде вашим другом!
- Природа реагентів: Природа реагентів істотно позначається на їхній реакційній здатності
Вчитель самостійно демонструє перед класом.
Питання до класу. 1. Які ознаки реакції ви спостерігаєте?
- У якій пробірці реакція відбувається швидше?
- Чому магній реагує найкраще?
Погляньте на ряд активності металів, щоб правильно відповісти на ці питання.
Про швидкість перебігу кожної з реакцій можна судити за інтенсивністю виділення бульбашок водню. Найшвидше з хлоридною кислотою реагує магній, не реагує – мідь. Отже, природа металів впливає на швидкість відновлення ними катіонів Гідрогену в розчині.
Лабораторний дослід №5
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість реакції.
Площа поверхні контакту реагентів.
Площа поверхні контакту реагентів – іще один чинник, від якого залежить швидкість хімічної реакції, в якій беруть участь тверді речовини.
Питання до класу. 1. Які ознаки реакції ви спостерігаєте?
- У якій пробірці реакція відбувається швидше?
- Чому залізні ошурки реагують швидше?
Подрібнення та розпорошення речовин збільшує ймовірність стикання активних частинок реагентів.
Концентрація реагентів впливає на швидкість хімічної реакції.
Питання до класу. 1. Які ознаки реакції ви спостерігаєте?
- У якій пробірці реакція відбувається швидше?
- Чому розведена кислота реагує повільніше?
Зі зменшенням концентрації реагентів зменшуватиметься частота зіткнень (у тому числі й активних) між їхніми частинками. Зі збільшенням концентрації реагентів збільшується кількість зіткнень (також активних) між їхніми частинками.
МОДЕЛЮВАННЯ НА КОМП’ЮТЕРІ ДОСЛІДУ У ПРОГРАМІ CROCODILE CHEMISTRY.
Температура впливає на швидкість хімічної реакції.
Температура, за якої відбувається хімічна реакція, також позначається на її швидкості.
Питання до класу. 1. Які ознаки реакції ви спостерігаєте?
- У якій пробірці реакція відбувається швидше?
- Чому нагріта кислота реагує краще.
За підвищенням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням вмісту активних молекул (чи інших структурних частинок у реакційній суміші). Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти довше зберігаються за низьких температур.
2. Каталізатор.
Пам’ятайте, що швидкість хімічної реакції можна збільшити, використовуючи каталізатор. Він змінює механізм реакції, спрямовуючи її перебіг.
ВІДЕОДЕМОНСТРАЦІЯ: Розклад гідроген пероксиду в присутності каталізатора.
Питання до класу. 1. Які ознаки реакції ви спостерігаєте?
- Чому в присутності MnO2 реакція відбувається швидше?
- Запишіть рівняння реакції визначте тип реакції за кількістю реагентів?
Вчитель розповідає про біологічні каталізатори-ферменти.
V. Узагальнення і систематизація знань, застосування їх в різних ситуаціях.
1.Аналізуємо ліву частину таблиці «Я знаю», заповнену на початку уроку, і дописуємо праву частину – «Про що дізнався».
Питання до учнів: 1. Чому продукти харчування зберігають в холодильнику?
2. Під час консервації продуктів використовують речовини – консерванти. Яку іншу назву можна дати цим речовинам?
ВСТАНОВІТЬ ВІДПОВІДНІСТЬ.
РОЗТАШУЙ ЯВИЩА ЗА ЗРОСТАННЯМ ШВИДКОСТІ РЕАКЦІЙ.
Задача-прогноз: Для дослідження реакції цинку з кислотою Петро взяв хлоридну кислоту, а Галинка – оцтову такої самої концентрації. Спрогнозуйте, у якому випадку реакція відбудеться швидше.
- Підведення підсумків уроку і домашнє завдання.
Міркування дітей над словами: «Є тільки дві форми життя: гниття і
горіння. Боягузи та жадібні оберуть першу, мужні та щедрі – другу».
Гниття і горіння – процес окиснення, що відбувається з різною швидкістю і якістю. Доречно пригадати стародавній закон лікарів: «Светя другим - згораю»(російською мовою).
- Домашнє завдання
Прочитати § 15 (Попель П.П., Крикля Л.С. Хімія - 9), завд. 143, 145. На оцінку 10-12 Додатково завдання 147, 148 с. 96-97.
Як варіант домашнього завдання:
Школа виживання!
За допомогою мережі Інтернет розробіть пам`ятку для тих, хто збирається у похід: Які продукти харчування краще брати з собою і чому?
- Як доцільніше зберігати продукти?
Додаток № 1
|
Зміст роботи |
Спостереження |
Висновок |
|
Неухильно виконуйте правила техніки безпеки
|
||
Лабораторна робота«Вплив хімічної природи реагентів на швидкість реакції»
|
Хімічна реакція між хлоридною кислотою і магнієм відбувається
із залізом_________ __________________ __________________ __________________ |
Швидкість хімічної реакції залежить від
|
Лабораторна робота«Вплив площі поверхні стикання речовин на швидкість реакції»
|
Зі збільшенням площі поверхні контакту реагентів швидкість реакції
|
Швидкість хімічної реакції залежить від
|
Лабораторна робота«Вплив концентрації речовин на швидкість реакції»
|
Зі збільшенням концентрації реагенту швидкість реакції
_________________ _________________ |
Швидкість хімічної реакції залежить від
|
|
Якщо реакція відбувається між газами, то її швидкість можна збільшити за допомогою тиску, бо в разі підвищення тиску концентрація газу збільшується. |
||


про публікацію авторської розробки
Додати розробку
