Розробка уроку з хімії для 10-го класу на тему "Застосування сполук Флуору, Брому та Йоду. Біологічне значення галогенів. Проблема охорони довкілля від забруднень сполуками Хлору.
Розробка уроку з хімії 10го класу профільного рівня на тему "Застосування сполук Флуору, Брому та Йоду. Біологічне значення галогенів. Проблема охорони довкілля від забруднень сполуками хлору. Розробив вчитель хімії Чугуївської загальноосвітної школи I - III ступенів №1 імені І.Ю.Репіна Чугуївської міської ради Харківської області у 2018 році.
Чугуївська загальноосвітня школа I - III ступенів
імені І.Ю.Рєпіна
Чугуївської міської ради Харківської області
ЗАСТОСУВАННЯ СПОЛУК ФЛУОРУ,
БРОМУ ТА ЙОДУ.
БІОЛОГІЧНЕ ЗНАЧЕННЯ ГАЛОГЕНІВ.
ПРОБЛЕМА ОХОРОНИ ДОВКІЛЛЯ ВІД
ЗАБРУДНЕНЬ СПОЛУКАМИ ХЛОРУ.
(10 КЛАС, ПРОФІЛЬНИЙ РІВЕНЬ)
Вчитель віщої категорії,
вчитель методист
Напльокова Ніна Кирилівна
Чугуїв
2018
Щоб запалити, потрібно горіти!
Тема. Застосування сполук Флуору, Брому, та Йоду.
Біологічне значення галогенiв.
Проблема охорони довкiлля вiд забруднень сполуками Хлору.
Мета. Узагальнити та систематизувати знання учнiв про застосування сполук галогенiв, біологічне значения галогенiв; розглянути проблему охорони довкiлля від забруднень сполуками Хлору.
Завдання уроку.
Освітні:
- розглянути галузі застосування сполук Флуору, Брому, та Йоду;
- довести бiологiчне значения галогенiв;
- спробувати розв'язати проблему охорони довкiлля вiд забруднень сполуками Хлору.
Виховні:
- довести учням провідну роль теорії в пізнанні практики;
- формувати в учнiв елементи наукового світогляду;
- довести матеріальність процесів, що вивчаються.
Розвивальні:
- розвиток логічного мислення шляхом порівняння, узагальнення, аналізу;
- виховувати культуру спілкування;
- показати вплив діяльності людини на природні процеси.
Тип уроку: коригування та систематизація знань Хімічні реактиви:
Розчини: натрiй хлориду, натрiй броміду, натрiй йодиду, аргентум нітрату, нітратної кислоти; хлорна вода, кристалічний йод, йодкрохмальний папірець.
Обладнання:
хімічні стакани, пробірки, демонстраційний столик, пальник, пробіркотримач.
Методи i форми роботи:
бесіда, робота в групах, повідомлення учнiв, демонстраційний експеримент, лабораторна робота.
„Або люди зроблять так, щоб у повітрі було менше диму, або дим зробить так, що на землі стане менше людей”
Л. Дж. Баттан.
ПЛАН УРОКУ.
І. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ УЧНІВ, ПОВІДПМЛЕННЯ ТЕМИ, МЕТИ, ЗАВДАНЬ УРОКУ.
Учитель. Протягом кількох останніх уроків ми з вами вивчали галогени, будову їх
атомів, фізичні, хімічні властивосгі. Сьогодні на уроці ми повинні систематизувати одержанні знання, навчитися застосовувати їх для вирішення нестандартних ситуацій. Ми маємо з'ясувати біологічне значення галогенів та чи дійсно існує проблема охорони довкілля від забруднень сполуками хлору.
ІІ. Бесіда
1) Назвіть елементи VII - A групи періодичної системи.
2) Яку будову мають: а) атоми;
б) молекули галогенів?
Покажіть це на електронних, графічних формулах. Яка загальна електронна конфігурація зовнішнього енергетичного рівня?
3) Як змінюється електронегативність цих елементів зі збільшенням атомного номера?
4) Як змінюється окислювальна здатність галогенів в групі зверху вниз?
5) Які ступені окиснення галоreнів в сполуках?
![]()

![]()
![]()
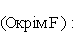
![]()
![]()
![]()
![]() -,
-,
-
 В яких сполуках галогени мають ступінь окиснення -1? (У сполуках з гідрогеном і металами?)
В яких сполуках галогени мають ступінь окиснення -1? (У сполуках з гідрогеном і металами?)
- Як одержують хлор: а) в промисловості;
б) в лабораторії?
а) в промисловості:
2NaCl + 2H2O--------------> 2NaOН + Cl2 + H2
б) в лабораторії:
НС1 + окисник
KclO3+6HC1=KC1+3Cl2+3H2O
 8) Як називаються водні розчини гідрогенгалогенідів?
8) Як називаються водні розчини гідрогенгалогенідів?
(кислоти)
(HF, HCl, HBr, HJ)
Яка з цих кислот найсильніша і чому?
ІІІ. Робота в групах.
1 група. Майбутні аналітики.
Завдания. Вивчити і пояснити застосування сполук Флуору, Брому, та Йоду. Відповіді учнів. Галогени зустрічаються в природі тільки у вигляді сполук.
Флуор - у вигляді солей, які розсіяні в різних гірських породах. Загальна кількісгь в земній корі 0,02% атомів.
CaF2 - плавиковий шпат; NaзA1F6 - кріоліт;
Ca5F(РО4)з — фторапатит
Хлор.
КС10з - калій хлорат;
HgCI2 - (сулема) — отрута, для дезінфекції і протравлення насіння; NaCl - галіт, сировина для одержання хлору;
NaOH — металічного натрію і гідрогенхлориду, соди.
Головна маса натрій хлориду знаходиться в воді морів і океанів. КСІ — сильвін (калійна соль) — добриво.
ВаС12 — отрутохімікат (с/г)
MgC12•КС1•6Н20 — карналіт.
KCI•NaCI — сильвініт.
СаС12 — безводний поглинає воду:
СаС12 + 6Н20 —> СаС12• 6Н20
Бром.
Зустрічається в природі у вигляді солей натрію і калію разом з хлоридами, а також в воді солоних озер і морів. В підземних бурових водах, які мають промислове значення, вміст брому складає від 170 до 700 мг/л.
Сполуки йоду є в морській воді, але в дуже малих кількостях. Ламінарії накопичують йод у своїх тканинах. Значна кількість йоду (від 10 до 50 мг/л) міститься в підземних бурових водах. Незначні поклади КJОз, KJ04 в Чилі і Боліварії.
Застосування.
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
5% водно-спиртовий розчин
нестача йоду в організмі приводить до захворювань щитовидноїзалози |
|||||
|
|
|
||||||
|
|
|||||||
|
|
|
|
для виробництва пластмас тефлон (-F2C-CF2-)n, високо- температурних мастил, рідин для холодильних машин. |
||||
|
|
|
||||||
|
|
|
||||||
2 Група. Майбутні біохіміки.
2 група учнів вивчають біологічне значення гaлогенів (робота з підручником с. 96 - 97) Лабораторний дослід № 2 с. 97.
Якісні реакціі на хлорид-, бромід-, та йодид- іони.
а) Сl- + Ag+ = AgCl↓білий (творожний)
b) Br- + Ag+ + AgBr↓ жовтий
с) J-+ Ag+ = AgJ↓ жовтий (творожний)
Застосування знань в нестандартних умовах. Послухайте уважно.
Королівський бал і металепсія.
Явище метaлепсії (поступового заміщення водню в органічних сполуках галогенами) відкрили зовсім випадково. Це було в 30-х роках минулого столітгя. Якось французький король наказав своїм вельможам і придворній челяді підготувати все необхідне для пишного і грандіозного балу. Для освітлення королівського пaлацу Тюїльрі виготояили величезну партію воскових свічок. А щоб вони мaли привабливий вигляд і тішили око, їх відбілили хлором.
Як тільки заграли музики і пари закружляли в танці, палац став наповнюватися важким туманом. Дихати ставaло все важче, у носі й горлі дряпaло, в очах різало. Шляхетні дами і кавaлери почали чхати і кашляти. Бaл довелося спішно припинити.
Відомому хіміку Ж.Б. Дюма доручили з'ясувати причину цього прикрого випадку. Він провів ретельні дослідження білих воскових свічок і знайшов головного „винуватця", який зірвав королівський бал. Ним виявився хлор, яким відбілювaли жовтий віск. Бджолиний віск - дуже складна суміш різнин сполук. Це насамперед вуглеводні (С25Н52 і С30Н62 ), вищі спирти (цериловий - С26Н53ОН, мірициловий - С30Н61ОН ),вищі карбонові кислоти (пaльмітинова - С15Н31СООН, мелісинова- С29Н59 СООН) і естери високомолекулярних кислот і спиртів, наприклад, мірицилпальмінат- С15Н31СООС30Н61. Внаслідок дії вільного кпору на віск атоми водню в його сполуках заміщувалися на гaлоген. Утворені хлорпохідні під час горіння свічок згоряли і серед інших продуктів реакції виділяли воду і хлороводень. Утворилися крапельки соляної кислоти, що у вигляді туману наповнили зaли пaлацу Тюїльрі.
У своїй доповідній записці до Французької академії наук Дюма повідомляє, що „хлор має дивовижну властивість притягувати водень і замінювати йогo атом за атомом”. Так було відкрито![]() явище метaлепсії, яке відігрaло революційну роль у розвитку органічної хімії.
явище метaлепсії, яке відігрaло революційну роль у розвитку органічної хімії.
Запишіть рівняння хімічних реакцій.
С25Н52 + Сl2 -> С25Н51Сl + НС1
С25Н51Сl + 37,5O2 = 25CO2 + НС1 + 25H2O
З Група. МАЙБУТНІ ЕКОЛОГИ
3 група учнів вивчають проблему охорони довкілля від забруднень сполуками Хлору. Робота з підручником (с. 98 - 98).
СlO2 - хлор діоксид - небезпечний.
3Сl2O2 —>2Сl2 +2СlO3
Захист довкілля : обробка гарячим розчином NaOH: 3Сl2 +6NaOH ->5NaCl + NaClO3 +3H2O
4Сl2O hy-> ЗСl2 + 2СlO2
2Сl2O + 4NaOH -> 3NaCl + NaCl04 + 2Н2O
8ClO3 + 8NаOH ->NaCl + 7NaClO4+ 4H2O
HClO3 і ії солі - хлорати: КСlO3, NaClO3, LiClO3, Са(СlO3)2, Mg(СlO3)2 використовуються в целюлозно-паперовій промисловості (вибілювання), як гербіциди і дефоліанти, компоненти піротехнічних сумішей, сірників.
Хлорати діють на кров:
гемоглобін → метгемоглобін,
спричиняючи розпад еритроцитів , блокують дихальну функцію гемоглобіну. Виникає кисневе голодання тканин, що може викликати ураження ЦНС.
Метгемоглобін повільно розкладається на гемоглобін, щоб прискорити цей процес, потрібно вдихати чистий кисень.
Щоб позбавити довкілля від забруднення цими сполуками Хлору, необхідно небезпечні місця їх знаходження обробити свіжоприготовленим розчином FeSO4 в розчині H2SO4 :
KCl5+O3 + 6Fe2+SO4 + 3H2 SO4 = 3Fе23+(SO4)3 + KCl1- + 3H2O
СЕБ:
Сl5+ + 6е → Cl- / 1 П.В.; Сl5+ - окисник
Fe2+ -1е →Fe3+ / 6 П.O.; Fe2+ - відновник
![]() Сl2О7 і НСlО4 - термостійкі.
Сl2О7 і НСlО4 - термостійкі.
КClО4 --------400 C→KCl + 2O2
Застосування знань на практиці.
На пляжі багато відпочиваючих. Як знезаражується пісок від хвороботворних мікробів, грибків?
Відповідь.
В морській воді розчинено багато солей, зокрема хлоридів та бромідів натрію, кальцію. Досліди довели, що в результаті електролізу морської води можливе утворення СlO- , який має бактерицидні властивості:
Сl- + H2O +2e →СlO- + 2H+
Аналогічні реакції відбуваються під дією УФ - випромінювання:
O2 + 2Сl- hy-> 2СlO-
O2 + 2Br- hy-> 2BrO-
Ось чому в пляжному піску практично не залишаегься бактерій.
IV..
- Лабораторна робота Ns 2 с. 97.
- Дослід - задача.
Довести практично, що хлор активніший за йод:
2KJ + Сl2 - 2КСl + J2
- Задача.
3 44,8 л гідрогенхлориду приготували 0,5 л розчину. Яка молярна концентрація одержаної хлоридної кислоти?
Розв'язок.
n(НС1) = 44,8л : 22,4 л/моль = 2 моль; См = n/V
См = 2 моль / 0,5л = 4моль/л
V. Висновки.
1 ГРУПА — ВИСНОВОК.
2 ГРУПА — ВИСНОВОК.
3 ГРУПА — ВИСНОВОК.
VI. Закріплення матеріалу.
- Здійснити перетворення
MnO2→ Cl2→ J2→NaJ→AgJ
записати рівняння реакцій в молекулярній та іонній формах (де це мoжливо)
- 3 якими речовинами реагує НВr: а) Са(ОН)2; b) РСl3; с) H2SO4 конц.; d) KJ; e) Mg; f) KСlO3
В яких випадках НВr проявляє властивості: а) кислоти; 6) окисника; в) відновника.
VII. Домашнє завдання Читати с. 96 - 99, с. 97 № 5, с. 98 № 7.


про публікацію авторської розробки
Додати розробку