розробка уроку з хімії для 8 класу "Кристалічні гратки."
Розробка уроку містить конспект уроку та презентацію. Презентація містить ілюстрований матеріал, що допоможе дітям краще запамятати матеріал уроку.
- .èα¿ßΓá½_τ¡_ úαáΓ¬¿..docx docx
- _τ¡_ úαáΓ¬¿.ppt ppt
Урок з хімії 8 клас
Тема: Кристалічні гратки. Атомні, молекулярні та йонні кристали.
Мета: дати поняття про кристалічні ґратки, ознайомити з різними типами кристалічних ґраток (атомні, молекулярні, йонні), розкрити зв'язок між типом хімічного зв’язку і типом кристалічних ґраток Розвивати вміння прогнозувати хімічні властивості сполук на підставі аналізу їх кристалічної решітки, вміння проводити аналіз, узагальнювати, робити висновки; вміння працювати з опорною таблицею, карткою-інструкцією. Виховання самостійності, наполегливості в досягненні своєї мети, культури праці.
Тип уроку: комбінований.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, опорна таблиця видів кристалічних граток, картка з інструкцією, моделі кристалічних граток, таблиця « Кристалічні гратки», презентація «Кристалічні гратки»
Хід уроку.
I. Організаційний момент
- Організація класу;
- налаштування на роботу;
- перевірка наявності підручників, зошитів, щоденників, канцелярського обладнання.
II.Актуалізація опорних знань
На попередніх уроках ми вивчали типи хімічних зв’язків. Цей матеріал буде потрібний нам для засвоєння наступної теми. Тож повторимо саме головне. Пригадайте, які типи зв’язку існують в природі?
Повторення проведемо у формі гри «Вірю –не вірю».
Твердження:
1. Йонний зв’язок виникає між йонами (так).
2. Йони – це нейтральні частинки (ні).
3. Йони – це заряджені частинки (так ).
4. Ковалентний зв’язок буває двох типів – полярний і неполярний (так).
5. Ковалентний полярний зв’язок утворюється між атомами з однаковою електронегативністю (ні).
6. Ковалентний неполярний зв’язок утворюється між атомами одного і того ж неметалу (так).
7. Ковалентний неполярний зв’язок утворюється між атомами з різною електронегативністю (ні).
8. NaCl – сполука з йонним зв’язком (так).
9. О2 – сполука з ковалентним полярним зв’язком (ні).
10. HCl –сполука з йонним зв’язком (ні).
III. Повідомлення теми уроку та мотивація учбової діяльності
Отже, існують різні типи зв’язку. Чи впливає тип хімічного зв’язку на будову речовини та її властивості? Саме цю проблему ми повинні з вами розв’язати на уроці.
Тема нашого уроку: Кристалічни гратки. Атомні, молекулярні та йонні кристали.
Про що б ви хотіли дізнатись? ( бесіда з учнями )
Визначимо мету пошуку знань?( учні ставлять мету, учитель допомагає, записуємо в зошиті і на дошці)
Тобі треба
Знати: поняття кристалічні гратки,типи кристалічних ґраток
Уміти: визначати типи кристалічних краток, прогнозувати властивості речовин залежно від виду хімічного зв'язку і типу кристалічних ґраток.
Розуміти: залежність фізичних властивостей речовин від їх кристалічної будови;
IV. Вивчення нового матеріалу:
4.1. Будова твердих речовин. Бесіда. Складання схеми.
Запитання:
- Які частинки утворюють речовини?
(Тобі вже відомі такі частинки, як атоми, молекули, йони. Це відносно проста форма організації речовини. У стандартних умовах ці частинки, як правило, індивідуально не існують.)
- Які речовини утворюють частинки? (За допомогою різних типів хімічних зв'язків вони
об'єднуються й утворюють вищу форму організації речовини — хімічні сполуки.)
- Як поділяються хімічні сполуки? (прості і складні речовини. Залежно від фізичних умов
речовини можуть існувати в різних агрегатних станах.)
- Які ви знаєти агрегатни стани хімічних сполук? ( з уроків природознавства та фізики: твердий, рідкий та газуватий стан)
Під час бесіди складем схему

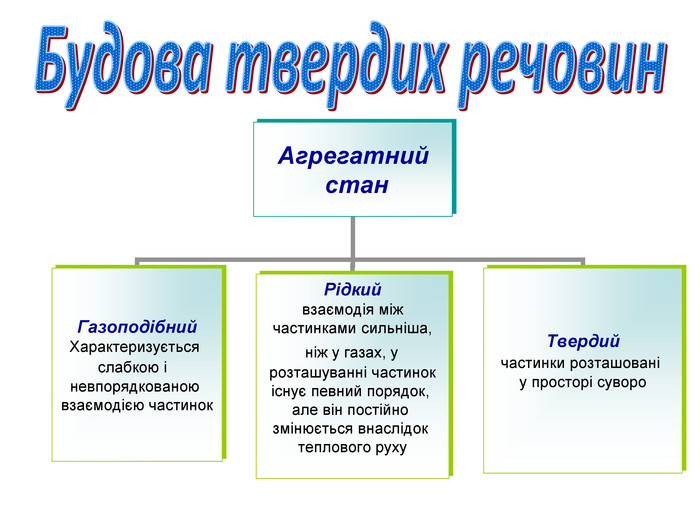
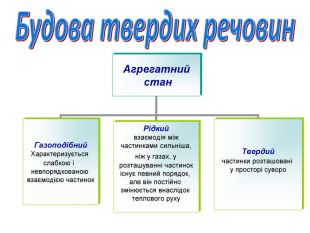
Агрегатний стан
(Якщо гази характеризуються повною невпорядкованістю розташування молекул одна відносно одної, то в рідинах деяка впорядкованість частинок спостерігається. Адже для рідин характерна наявність певного об'єму, хоча й відсутня певна форма. Рідини займають проміжне місце між газами і твердими тілами, яким властивий суворий порядок розташування частинок, що утворюють речовину.У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини.)
Скажіть, в якому агрегатному стані можуть бути речовини? (газоподібному, рідкому та твердому). Твердих речовин найбільше. При певних умовах будь-яка речовина може стати твердою. Як ми говоримо – перетворитися на камінь.
Ось так. Камінь – об'єкт оточуючого світу. І, оскільки, у нас урок хімії, ми розглянемо цей об’єкт з хімічної точки зору. Які запитання ми можемо поставити?
- Які частинки утворюють тверді речовини?
- Як вони сполучаються між собою?
- Як це впливає на властивості?
-
Як ці властивості можна використати людству?
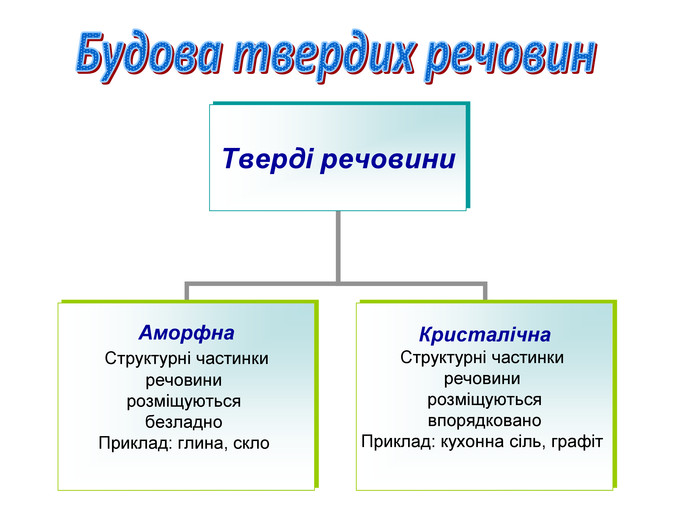
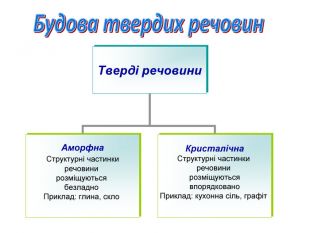
- Усі речовини у твердому стані можуть мати таку будову:
|
|
Будова твердих речовин |
|
||
|
|
||||
|
Аморфна |
|
Кристалічна |
||
|
Структурні частинки речовини розміщуються безладно |
|
Структурні частинки речовини розміщуються впорядковано |
||
|
Приклад: глина, скло |
|
Приклад: кухонна сіль, графіт |
||
Евристична бесіда
Відомо, що у твердих речовинах частинки, що їх утворюють, розташовані у просторі суворо закономірно для кожної речовини.
Кожна тверда речовина має свою кристалічну гратку. Прочитаємо, що таке кристалічна гратка (С. 178).
Кристалічна гратка – це розміщення в просторі йонів, атомів або молекул у певному систематичному порядку. (У кристалічних речовинах атоми, молекули та йони розташовані упорядковано, на певних відстанях. Таке закономірне розташування частинок у кристалах називають кристалічною ґраткою. Щоб якось уявити цю закономірність, у тривимірному просторі об’єднаємо центри молекул прямими лініями, які перетинаються. При цьому утвориться просторовий каркас, який називають кристалічними ґратками.. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток ( демонстрація моделей кристалічних ґраток)
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів)
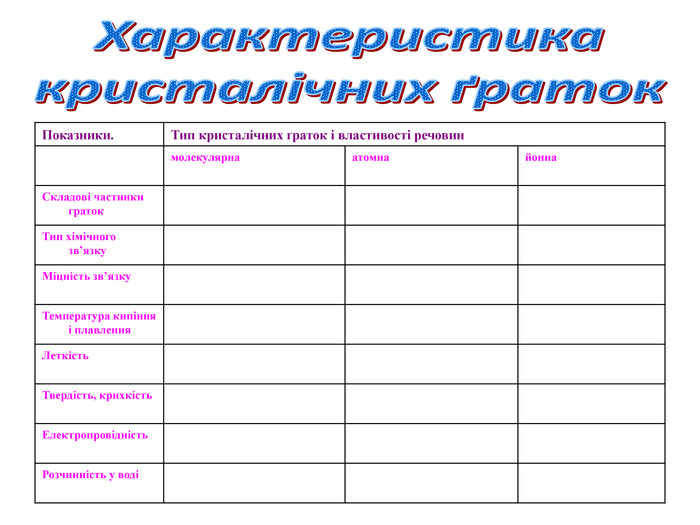
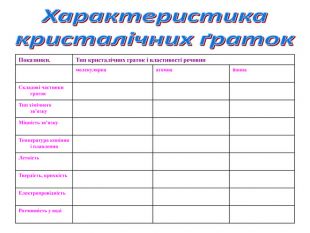
4.2 Класифікація кристалічних ґраток.
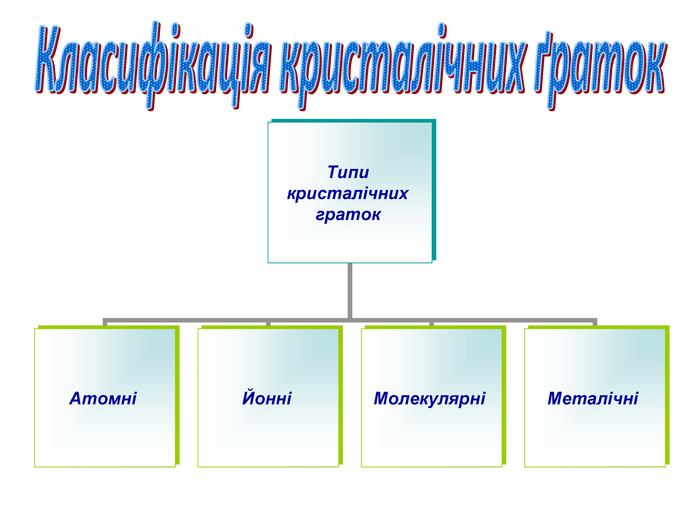
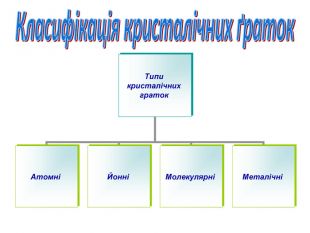
Залежно від природи частинок, що містяться у вузлах кристалічних ґраток, та сили взаємодії між частинками визначають тип ґраток: йонні, атомні, молекулярні.
Відомі ще й. металічні кристалічні ґратки, їх вивчатимемо пізніше
Класифікація кристалічних граток.
|
Типи кристалічних граток |
|
|||||||||||
|
|
|
|
|
|
||||||||
|
АТОМНІ |
|
ЙОННІ |
|
МОЛЕКУЛЯРНІ |
|
МЕТАЛІЧНІ |
||||||
Робота в групах. Кожна група отримала завдання описати один певний вид гратки. В своїх проектах ви обов’язково мали дати відповіді на чотири запитання:
1. Які частинки лежать у вузлах кристалічної гратки.
2 Які сили між ними діють.
3. Які властивості виявляють речовини.
4. Навести приклади речовин.
Надаємо слово першій групі.
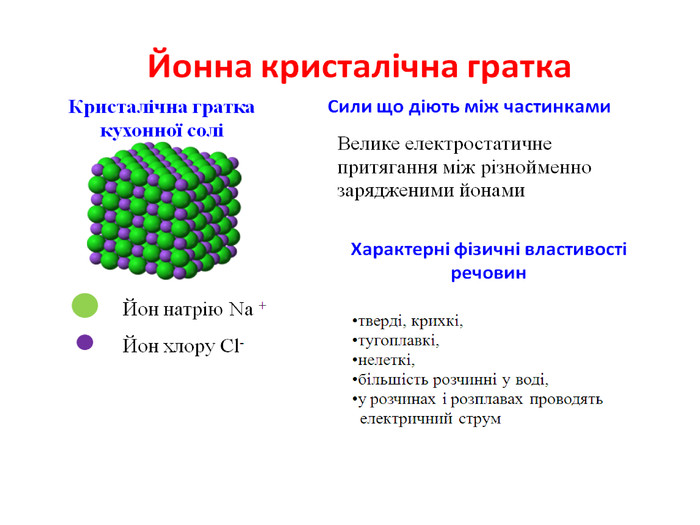
Йонна кристалічна гратка
- Ви вже знаєте, що переважна більшість твердих речовин мають кристалічну будову. Залежно від того, які частинки утворюють кристал, розрізняють різні види кристалічних граток. Ми розкажемо про йонну кристалічну гратку.
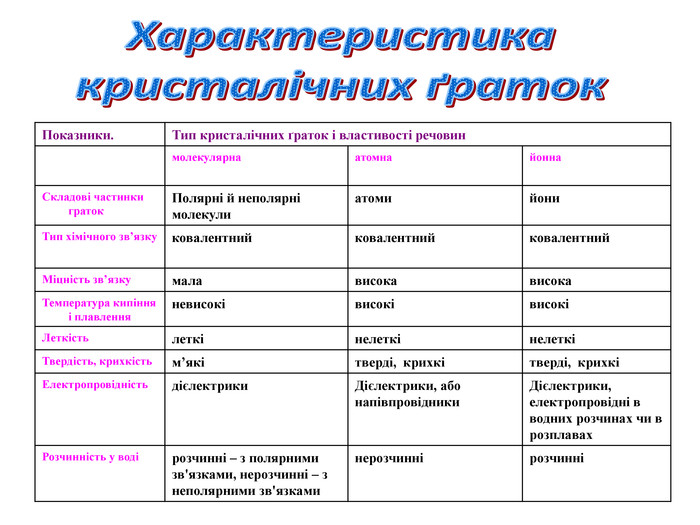
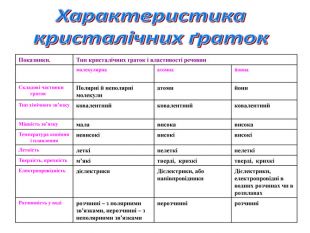
У вузлах йонних кристалічних граток лежать йони, тому гратки і отримали таку назву – йонні.
Йони, як ви знаєте, бувають позитивні і негативні. У вузлах граток вони розташовані так, що навколо позитивного йона розташовані негативні, а навколо негативного – позитивні.
Наприклад, у кристалічній гратці натрій хлориду, тобто кухонної солі, кожен йон натрію оточений шістьма йонами хлору, а кожен йон хлору оточений шістьма йонами натрію.
Йонні кристалічні гратки характерні для речовин з йонним зв’язком.
2. Я розповім про те, які сили діють в йонних гратках і як це впливає на властивості речовин.
Оскільки йони заряджені протилежно, між ними виникають значні сили притягання. Зруйнувати таку гратку нелегко. Для того, щоб зруйнувати кристал, необхідно затратити велику кількість енергії, саме тому всі речовини з йонною граткою є твердими. Температура плавлення їх досить висока. Наприклад, кухонну сіль можна розплавити при температурі 801˚С. Рекордсмен по тугоплавкості серед йонних сполук – магній оксид. Його можна розплавити при температурі 2800˚С.
Це нелеткі речовини, тому не мають запаху. Вони крихкі. Більшість добре розчиняється у воді, розчини таких речовин проводять струм.
3. Речовини з йонною кристалічною граткою можна зустріти в природі, в побуті. Ви вже чули, що до речовин з йонною граткою відноситься всім відома кухонна сіль – натрій хлорид. Інші солі також мають таку решітку. Луги, наприклад, натрій гідроксид, кальцій гідроксид. Оксиди металів, наприклад, алюміній оксид – Аl2O3.
Надаємо слово другій групі.
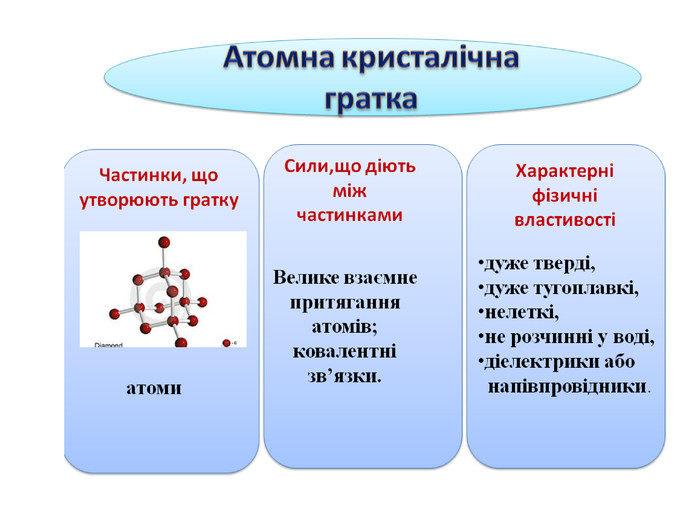
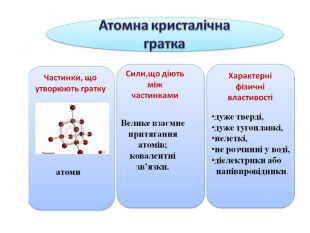
Атомна кристалічна гратка
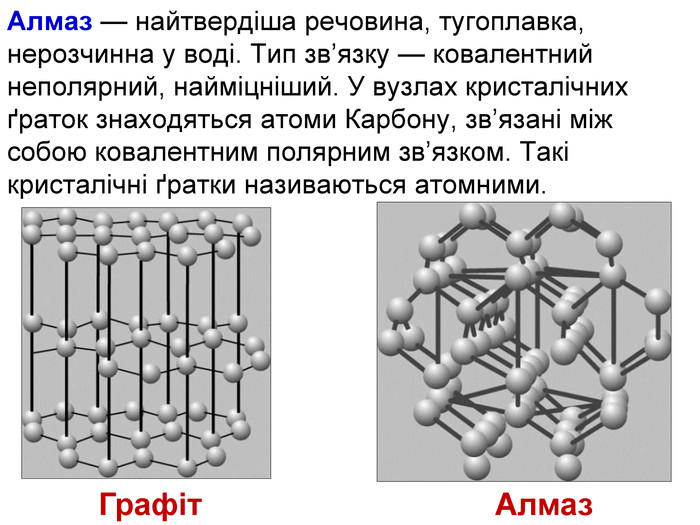
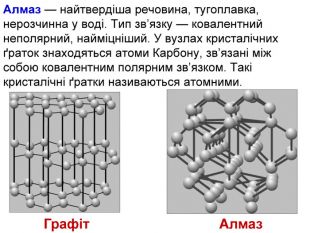
1. Наша група готовила матеріал про атомну кристалічну гратку. Я думаю, що ви вже здогадалися, що раз гратка називається атомною, то у вузлах гратки лежать атоми. Перед вами схема будови кристала алмаза. Кожна кулька – це атом Карбону. Всі атоми розташовані один від одного на однаковій відстані. А це схема будови кристала графіту. Тут у вузлах лежать ті ж самі атоми Карбону, але розташування атомів інше – шарувате. Тут немає окремих йонів або молекул. Весь кристал являє собою неначе одну велетенську молекулу.
2. Ви тільки що чули, що в йонних гратках діють значні сили притягання між йонами. Між атомами діють ще більші сили притягання, утворюються дуже міцні ковалентні зв'язки. Зруйнувати їх ще важче, ніж зв'язки між йонами. Тому всі речовини з атомними кристалічними гратками дуже тверді, дуже тугоплавкі, нелеткі. Наприклад, температура плавлення алмаза становить 3500˚С. Крім того, алмаз є самою твердою речовиною в природі.
Ці речовини не розчиняються у воді. Вони не проводять струм, або бувають напівпровідниками.
3. Атомні гратки має невелика кількість речовин. Це алмаз, з якого роблять діаманти, алмазом ріжуть скло, бурять гірські породи. Зараз у кожного з вас теж є речовина з атомною кристалічною граткою. Це графіт, який знаходиться в олівцях. Нам добре знайомий пісок – SO2. Це також речовина з атомною граткою. Цей предмет, я думаю, вам також знайомий. Ним точимо ножі, сапи завдяки його великій твердості. Називається речовина – силіцій карбід. У його кристалічній гратці чергуються атоми Карбону і Силіцію. Саме ці атоми утворюють атомну кристалічну гратку.
Надаємо слово третій групі.
Молекулярна кристалічна гратка
1. Ще один тип граток, що існує в природі, – молекулярні кристалічні гратки. Речовини з такими гратками дуже відрізняються від речовин з йонними та атомними гратками. Причина полягає в тому, що у вузлах лежать молекули. На цьому малюнку зображена кристалічна гратка йоду. У вузлах гратки розташовані молекули йоду – І2. А на цьому малюнку зображена гратка вуглекислого газу. За певних умов він може ставати твердим, тоді його називають сухим льодом. У вузлах лежать молекули СО2. А ось це модель кристалу звичайного льоду. У його вузлах лежать молекули води – Н2О. Молекулярні кристалічні гратки можуть утворювати речови, що мають ковалентні зв’язки.
2. Між молекулами діють дуже слабкі сили міжмолекулярного тяжіння. Їх називають силами Ван-дер-Ваальса. Якщо сили притягання слабкі, то й зруйнувати їх дуже легко. Тому всі речовини із молекулярною кристалічною граткою мають невелику твердість, вони легкоплавкі. Наприклад, кристали йоду можна розплавити про 30˚С, а лід плавиться вже при 0˚С. Це леткі речовини, тому майже всі мають запах. Пригадайте нафталін, яким відлякують міль від одягу, що зберігається в шафах. Речовини з молекулярною граткою не проводять струм. Вони мають різну розчинність у воді.
3. Речовини з молекулярною граткою дуже поширені. Я вам покажу деякі з них. Ось кристали йоду. Спиртовий розчин йоду використовують в медицині, він є у кожного із нас вдома. А це цукор. Звичайний цукор, з яким ми п’ємо чай. Молекулярну гратку має лід. Досить його дістати із холодильника, як він починає танути, що доводить наявність молекулярної гратки.
Як же можна визначити тип кристалічних граток? У кожного на парті є інструкція визначення типу кристалічних ґраток.
Інструкція з визначення типу кристалічної гратки
Визначити до якої групи відноситься дана речовина:
-
Проста речовина – визначити метал чи неметал:
- Ме – мають металічну кристалічну гратку;
- неМе – мають молекулярну кристалічну гратку;
- винятки – деякі неМе мають атомну кристалічну гратку.
-
Складна речовина – визначити клас речовини:
- МехОу – йонну кристалічну гратку;
- неМехОу – молекулярну кристалічну гратку;
- Ме(ОН)х – йонну кристалічну гратку;
- НхAn – йонну кристалічну гратку;
- MeхAnу – йонну кристалічну гратку.
Використаємо її на практиці.
Визначити тип кристалічних граток хімічних сполук: Са, О2, SO3, HCl,
V.Закріплення матеріалу.
Азот переходить у твердий стан за низької температури (-210˚С). Який тип гратки має азот? (молекулярна)
- Яка з речовин характеризується більшою твердістю – лід чи пісок? Як ви це можете пояснити? (лід має молекулярну, а пісок атомну гратку)
- Елементи С і Sі утворюють схожі за складом оксиди СО2 і SіО2, але СО2 плавиться при -78.5˚С, а SіО2 при +1700˚С. Як ви це можете пояснити? (різні кристалічні гратки)
- Білий фосфор плавиться при +44,2˚С. Яку кристалічну гратку має білий фосфор? (молекулярну)
- Червоний фосфор плавиться при +600˚С. Яку кристалічну гратку має червоний фосфор? (атомну)
VI. Домашнє завдання:§, №
VII. Підведення підсумків уроку.
Чи досягли ми мету, яку поставили? Сподобався вам урок? Якщо сподобався, завершимо урок оплесками.


про публікацію авторської розробки
Додати розробку