Розробка уроку з хімії для 8 класу по темі " Хімічні властивості кислот".
Розробка містить конспект уроку та презентацію до уроку хімії по темі " хімічні властивості кислот". Презентація урізноманітнить урок з хімії та зацікавить дітей вивчати до її вивчення.
Урок з хімії. 8 клас
Тема: Хімічні властивості кислот. Використання кислот
Мета: закріпити знання про основні типи хімічних реакцій, їх особливості; дати поняття про умови протікання реакцій обміну до кінця та використання кислот; формувати вміння складати рівняння хімічних реакцій, що характеризують хімічні властивості кислот та оксидів.
Обладнання: роздатковий матеріал, мультимедійний проектор, комп’ютер, таблиці «Розчинність кислот, основ і солей у воді»
Форми роботи: бесіда, робота біля дошки, демонстрація, лабораторний дослід, робота з підручником
Хід уроку:
І. Організація класу
ІІ. Актуалізація опорних знань
Ребуси.
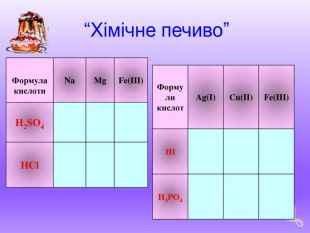
- Класифікувати речовини: CO2, Ca(OH)2, FeCl3, Na, O2, H2SO4, HBr, K2S, Li2O, Fe(OH)3, Cu(NO3)2, Cr2O3, Cu, H2.
- Дописати рівняння та визначити типи реакцій:
- Ca + H2SO4 →
- SO2 + Na2O→
- HgO →
- HCl + NaOH →
- Які хімічні властивості характерні для кислот?
ІІІ. Оголошення теми і мети уроку
IV. Мотивація навчальної діяльності
Кислоти переважно вступають в реакції заміщення та обміну.
Проблема: Які особливості протікання даних реакцій?
V. Вивчення нового матеріалу
- Основні типи хімічних реакцій (проектуються на екран):
- Сполучення: А + В → С
- Розкладу: А → В + С
- Заміщення: А + ВС → АС + В
- Обміну: АВ + СD → AD + CB
- Особливості реакцій заміщення: елемент, яким утворена проста речовина має бути активнішим, ніж той, що входить до складу складної речовини.
Наприклад: взаємодія металів з кислотою.
- Три умови протікання реакцій обміну до кінця:
- випадання осаду (↓) – нерозчинні речовини (Дається поняття про користування таблицею «Розчинність кислот, основ і солей у воді»)
- виділення газу (↑): H2S↑, H2CO3 (CO2↑ + H2O), H2SO3 (SO2↑ + H2O), NH4OH (NH3↑ + H2O)
- утворення води
- Демонстрація №5 «Добування хлоридної кислоти і досліди з нею»
- Лабораторний дослід №2. «Взаємодія хлоридної кислоти з металами»
- Робота з підручником. Використання кислот. Після опрацювання – обговорення матеріалу.
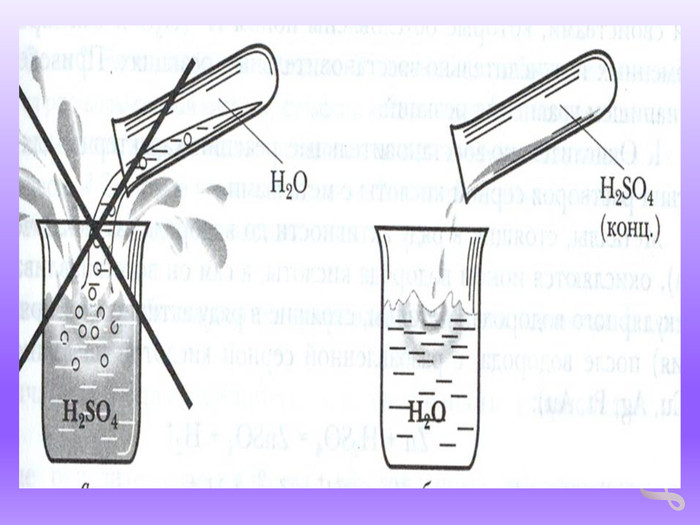
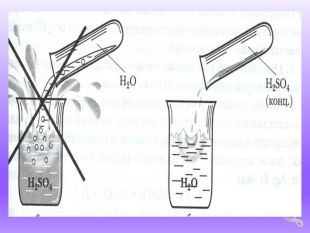
Правила роботи з кислотами.
Вивчення хімічних властивостей кислот ми проведемо за планом:
• Дія кислот на індикатори
• Взаємодія кислот з металами
• Взаємодія кислот з оксидами
• Взаємодія кислот з основами
• Взаємодія кислот із солями
1) Лабораторна робота № 1. Дія кислот на індикатори
Для проведення цієї лабораторної роботи ми використаємо пластинку для мікрометоду.
Акуратно капаємо в перший ряд по дві краплі хлоридної кислоти, у другий ряд — по дві краплі сульфатної кислоти. Далі в перше заглиблення з кислотами додаємо одну краплю метилового оранжевого, у друге — одну краплю лакмусу, у третє — одну краплю фенолфталеїну.
На підставі спостережень заповнюємо таблицю.
Висновок. У розчинах кислот метиловий оранжевий набуває червоного забарвлення, лакмус — рожевого. Отже, розчини кислот можна визначити з допомогою індикатора метилоранжу або лакмусу.
2) Демонстрація 4
Розглянемо, як взаємодіють кислоти з металами.
Для експерименту в три пробірки наливаємо хлоридну кислоту; у першу додаємо шматочки мідного дроту, у другу — гранули цинку, у третю — магнієву стружку.
— Чому метали неоднаково реагують із кислотою?
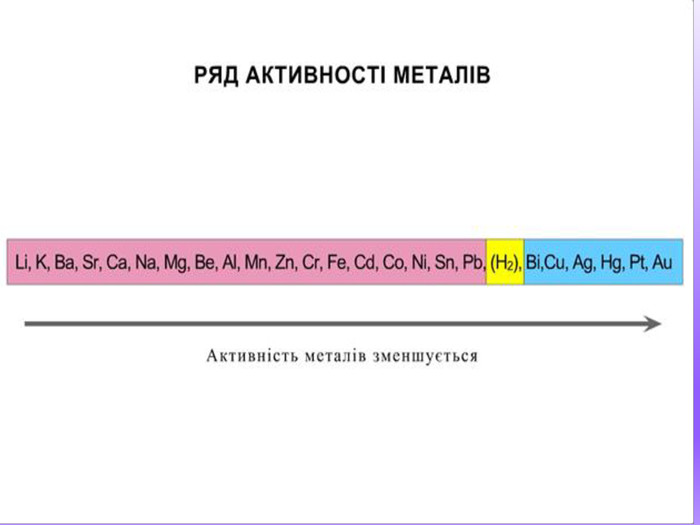
Це пов’язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших.
Цей ряд так і називається — ряд активності металів. (Розглядаємо таблицю, знаходимо ряд активності металів у підручнику.) Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот, і ті, що не взаємодіють із розчинами кислот і водень не витісняють.
Запишемо рівняння реакцій:
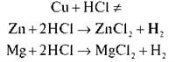
Укажіть тип реакції. (Реакція заміщення)
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад:
![]()
3) Із попередніх уроків ми знаємо, що кислоти можуть реагувати тільки з якими оксидами? (З основними)
Насиплемо в пробірку кальцій оксид, додамо розчин хлоридної кислоти. Що спостерігаємо? (Оксид розчинився)
Запишемо рівняння реакції:
СаО + 2НСl СаСl2 + Н2O
Укажіть тип реакції.
Це реакція обміну — дві складні речовини обмінюються своїми складовими.
4) У пробірку наливаємо натрій гідроксид, додаємо кілька крапель фенолфталеїну — розчин забарвлюється в малиновий колір. Потім по краплях додаємо хлоридну кислоту. Яку ознаку реакції спостерігаємо? (Знебарвлення розчину)
Запишемо рівняння хімічної реакції:
NaOH + НСl = NaCl + Н2О
— Чому знебарвлюється розчин? (Середовище стало нейтральним) Укажіть тип реакції. (Реакція обміну)
Така реакція між розчинами кислот і основ називається реакцією нейтралізації. Поясніть, чому.
Висновок. Кислоти взаємодіють із солями.
5) Кислоти можуть витісняти більш слабкі кислоти з їхніх солей. Здійснимо реакцію, яку вам доводилося спостерігати багато разів, коли мама гасила оцтом соду.
Наливаємо в пробірку розчин натрій карбонату й додаємо кілька крапель хлоридної кислоти. З'являються бульбашки газу — ознака протікання хімічної реакції. Запишемо рівняння:
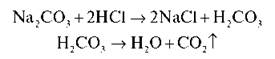
VІ. Закріплення вивченого матеріалу
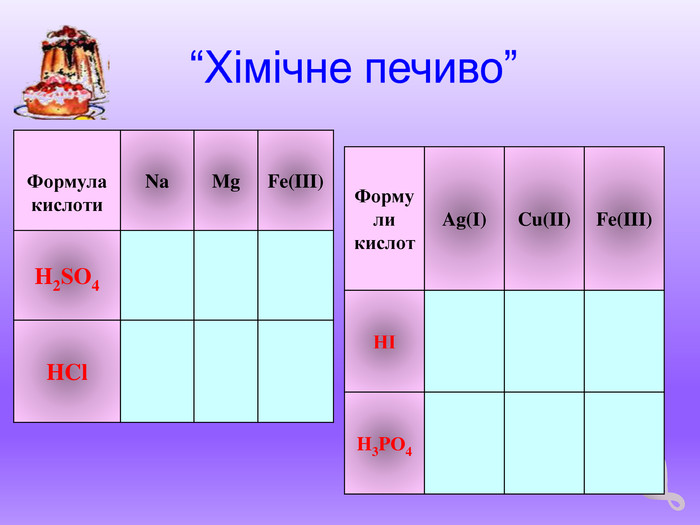
Допишіть рівняння можливих реакцій (робота біля дошки):
- Zn + H2SO4 →
- Ag + H2SO4 →
- Al + H3PO4 →
- Hg + HCl→
- Mg(OН)2 + H2SO4→
- CaCl2 + H2SO4 →
- Cu(NO3)2 + H2S →
- KOH + H3PO4 →
VІ. Підведення підсумків уроку
VІІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку