Розробка уроку з хімії на тему: Поняття про оксиди, окиснення, горіння. Умови виникнення і припинення горіння
Тема: Поняття про оксиди, окиснення, горіння. Умови виникнення і припинення горіння.
Мета: розширити та поглибити знання про процеси горіння та окиснення, поглибити знання про оксиди, розвивати навики складання формул оксидів відповідно до валентності, складання назв оксидів;
розвивати вміння складати рівняння реакцій, визначати тип реакції; формувати вміння пояснювати суть процесів окиснення та горіння, аналізувати умови виникнення та припинення горіння;
виховувати бережливе ставлення до довкілля, відповідальність за безпеку власного життя та оточуючих нас людей.
Тип уроку: урок засвоєння нових знань
Форми роботи: робота в парах та індивідуальна робота, бесіда.
Обладнання та реактиви: періодична система хімічних елементів, опорні схеми «Оксиген. Кисень»
Література:
1.Програма «Хімія» 7-12 класи . К. ,Ірпінь: ВТФ «Перун», 2005
2. Попель П. П., Крикля Л.С.. Хімія: Підручник для 7 кл. серед. загальноосвіт. шк. – Київ «Академія», 2007,136 с.
3.Лашевська Г. А. Хімія: 7 кл.: Підручн. для загально освіт. навч. зал. – К.: Ґенеза, 2007
4.Хімія. 7 клас. Дидактичні матеріали до курсу / Упоряд. К. М. Задорожний. – Х.: Основа, 2007
5.Старовойтова І. Ю., Люсай О. В. Усі уроки хімії. 7 клас. – Х.: Основа, 2007
Розробка уроку з хімії на тему:
Поняття про оксиди, окиснення, горіння. Умови виникнення і припинення горіння
(7 клас)
7 клас
Тема: Поняття про оксиди, окиснення, горіння. Умови виникнення і припинення горіння.
Мета: розширити та поглибити знання про процеси горіння та окиснення, поглибити знання про оксиди, розвивати навики складання формул оксидів відповідно до валентності, складання назв оксидів;
розвивати вміння складати рівняння реакцій, визначати тип реакції; формувати вміння пояснювати суть процесів окиснення та горіння, аналізувати умови виникнення та припинення горіння;
виховувати бережливе ставлення до довкілля, відповідальність за безпеку власного життя та оточуючих нас людей.
Тип уроку: урок засвоєння нових знань
Форми роботи: робота в парах та індивідуальна робота, бесіда.
Обладнання та реактиви: періодична система хімічних елементів, опорні схеми «Оксиген. Кисень»
Література:
- Програма «Хімія» 7-12 класи . К. ,Ірпінь: ВТФ «Перун», 2005
- Попель П. П., Крикля Л.С.. Хімія: Підручник для 7 кл. серед. загальноосвіт. шк. – Київ «Академія», 2007,136 с.
- Лашевська Г. А. Хімія: 7 кл.: Підручн. для загально освіт. навч. зал. – К.: Ґенеза, 2007
- Хімія. 7 клас. Дидактичні матеріали до курсу / Упоряд. К. М. Задорожний. – Х.: Основа, 2007
- Старовойтова І. Ю., Люсай О. В. Усі уроки хімії. 7 клас. – Х.: Основа, 2007
ХІД УРОКУ
- Організаційний момент
- Перевірка присутності учнів на уроці.
- Перевірка готовності до роботи (наявність зошитів, підручників).
- Перевірка домашнього завдання.
- Створення «ситуації успіху».
Наш сьогодняшній урок я хочу розпочати словами видатного французького письменника Віктора Гюгю: «Розум людини має три ключі: знання, думка, уява.»
Хочу побажати, щоб наш урок допоміг вам зробити ще один крок у здобутті цих чарівних ключів. А для того, щоб заняття було плідним потрібний відповідний настрій. Фізкультхвилинка.
- Підготовка до сприйняття матеріалу, актуалізація опорних знань.
Відгадайте, про яку речовину говориться у вірші:
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья,
Ярче в нем горит свеча.
Он не вреден для дыханья.
Новый газ из колбы вышел –
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит.
Вчитель: -Про який газ йде мова у даних рядках? Чому ви так думаєте?
Учні. Цей газ — кисень. Кисень — це газ, який всі живі організми використовують для дихання, він підтримує горіння. Крім того ми знаємо, що кисень отримав Джозеф Прістлі, розкладаючи Гідраргірум оксид (стара назва Оксид ртуті) і перевіряв його на досліді з мишами, встановив, що кисень підтримує дихання.
- Чи вірно буде сказано, що «кисень відкрив Дж. Прістлі»?
Учні. Це твердження буде вірне лише на половину.
Світовий пріоритет відкриття кисню належить Китаю. Китайський вчений VIII століття Мао-Хоа виявив у складі повітря два гази, один з яких мав властивість підтримувати дихання і горіння.
У Європі кисень відкрили майже через 1000 років. Михайло Васильович Ломоносов у 1750 році провів досліди і довів, що до складу повітря входить речовина, яка окислює метали. А у 1771 році швецький хімік Карл Вільгельм Шеєлє добув кисень і встановив, що повітря містить кисень і азот. І лише у 1774році англійський хімік Джозеф Прістлі добув кисень з оксиду ртуті.
Однак головні особи в історії відкриття кисню не Шеєлє та Прістлі. Вони відкрили лише новий газ. Особливе значення в історії відкриття кисню мають праці Лавуазьє. Він у 1775 році встановив, що кисень складова повітря, створив кисневу теорію горіння
Фронтальне опитування з складанням опорного конспекту.
- Мотивація навчальної діяльності
- Повідомлення теми, мети, завдань уроку. Цілепокладання, визначення очікуваних результатів
Очікувані результати:
1. Сформувати з поняттями “ горіння ”,“ окиснення ”;
2. Порівняти процеси горіння та окиснення;
3. Дослідити умови виникнення та припинення горіння;
4. Ознайомитися з заходами протипожежної безпеки у побуті і на виробництві, механізмом дії засобів пожежогасіння
- Вивчення нового матеріалу (первинне засвоєння, формування умінь та навичок, сприяння здобуттю знань учнями)
- 1. Дослідимо процес взаємодії речовини з киснем .
Лабораторна робота № 9. Реакція кисню з міддю
Інструктаж з правил БЖД
Мета: дослідити взаємодію міді з киснем, розвивати навики виконання нескладних хімічних експериментів, описувати спостереження та робити висновки
Хід роботи
Нагрійте на повітрі за допомогою спиртівки мідну дротину з очищеною поверхнею. Спостерігайте зміни.
-
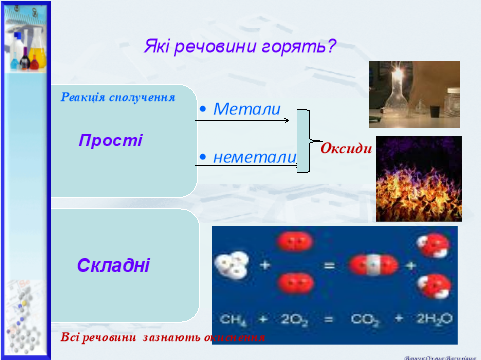
Горіння – хімічна реакція, під час якої виділяється теплота і з'являється полум'я.
Під час горіння речовина зазнає окиснення.
- Чи всі речовини можуть горіти? Чи вірно говорити: кисень горить?
- Які речовини не горять за звичайних умов?
- Умови виникнення і припинення горіння (Наявність горючої речовини, нагрівання до температури займання, доступ кисню).
- Осмислення нових знань, умінь (Використання вивченого у стандартних умовах):
6.1.Складіть рівняння реакцій горіння:
І варіант ІІ варіант:
а) сірки: S + O2 а) вугілля: C+O2
б) магнію: Mg + O2 б) кальцію: Ca +O2
в) алюмінію: Al +O2 в) водню:H2 +O2
6.2. Дайте назви речовинам, що утворилися внаслідок реакції. До якого класу вони належать.
- До якого типу належать дані реакції.
6.3. Складаємо опорну схему «Горіння простих та складних речин»
- Творче використання знань, умінь, навичок у життєвих ситуаціях
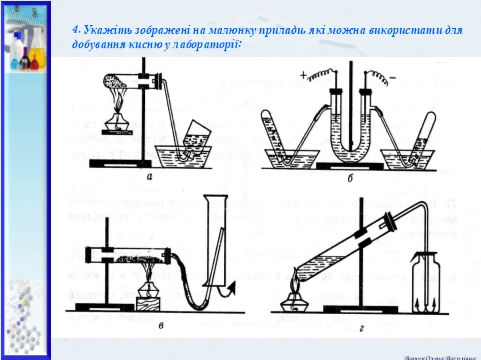
7.1. Розвязування задач - малюнків. Вкажіть указані на малюнку прилади. Які з них можна використовувати для добування кисню у лабораторії. Відповідь обгрунтуйте.
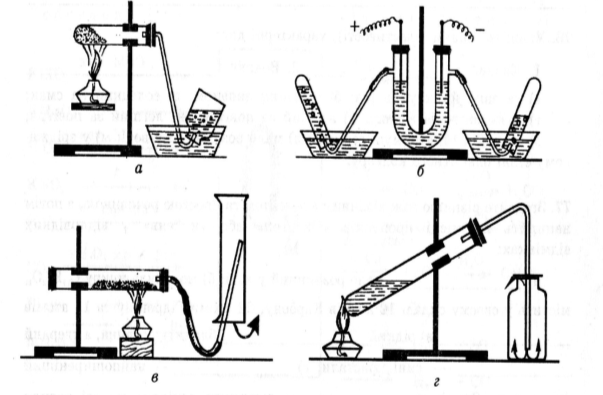
7.2. Експеримент ужиткового характеру
У пробірку з харчовою содою додайте оцту. Одразу ж розпочнеться реакція з бурхливим виділенням вуглекислого газу.
Після того, як вона закінчиться, запаліть сірник і повільно опускайте його у склянку. Що спостерігаєте? Чому сірник тухне?
7.3. Експериментальна задача: У мене є дві колби: в одній кисень, в іншій – повітря. Але я не пам’ятаю в якій колбі, який газ. Як дізнатися де який?
- Процес взаємодії речовини з киснем може відбуватися швидко, енергійно, з виділенням теплоти і появою полум’я.
7.4. Демонстрація досліду: Горіння магнію, заліза.
7.5. Задача- малюнок:Поясніть, чому свічка в одному з випадків на малюнку тухне?
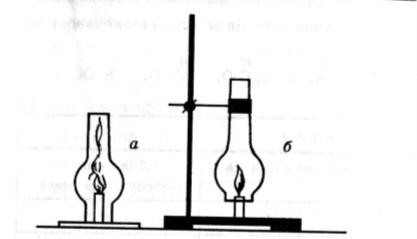
-
Узагальнення та систематизація знань
- Сформулюйте, які умови слід створити для виникнення горіння? Для припинення горіння? (дивимося слайд 13)
- Правила гасіння пожежі. Робота з вогнегасниками різних типів (слайд 14)
- Аналіз результатів роботи, підведення підсумків, рефлексія та самооцінка
- Контроль та корекція сформованості компетентностей
Скласти рівняння за схемами:
І варіант
CuS + … → CuO + SO2
PH3 + O2 → P2O5 + …
CS2 + O2 → SO2 + …
ІІ варіант
CH4 + … → CO2 + …
P2S5 + O2 → P2O5 + …
SiH4 + O2 → SiO2 + …
- Заповніть таблицю на різних етапах роботи:
|
|
Самооцінка |
Оцінка сусіда |
Завдання середнього рівня |
Завдання високого рівня |
Кількість балів за усні відповіді |
Оцінка вчителя за експери-ментальну частину |
Сумарний бал |
|
Максимально можливий бал |
|
|
|
|
|
|
|
|
Досягнення |
|
|
|
|
|
|
|
- Спонукання особистості до подальшого саморозвитку та самоосвіти. Ознайомлення з домашнім завданням, інструктаж щодо його виконання: п. 19 № 147, 149 (початковий рівень); № 148, 150 (середній рівень); № 151, 152 (достатній рівень); № 153 (високий рівень)
Картка рефлексії
Прочитайте запитання у таблиці. Поставте знак «+» у ту колонку, яка відповідає вашому рівню обізнаності з даного питання. Підрахуйте, у якій колонці у вас найбільше «+», і виберіть відповідний «смайлик». Прикріпіть його у лівому кутку вашої картки.
|
Запитання |
Добре знаю (напишіть відповідь у цій колонці) |
Знаю, але не впевнений |
Здогадуюcь |
Не знаю |
|
Як називається процес взаємодії речовин з киснем? |
|
|
|
|
|
Що таке горіння? Як відрізнити горіння від інших явищ? |
|
|
|
|
|
При яких умовах виникає горіння? |
|
|
|
|
|
Як припинити горіння? |
|
|
|
|
|
Які продукти утворюються внаслідок горіння? |
|
|
|
|
|
Як називати продукти горіння? |
|
|
|
|
|
Чи завжди реакцію взаємодії речовини з киснем називають горінням? Чому? |
|
|
|
|
|
«Смайлик» |
|
|
|
|
Презентація до уроку















про публікацію авторської розробки
Додати розробку




