Розробка уроку з теми "Кристалічні гратки. Будова речовин".
Хімія 8 клас.
Тема: Будова твердих речовин. Кристалічні гратки.
Мета: довести взаємозв’язок між будовою речовини та її властивостями на прикладі кристалічних граток твердих речовин; сформувати уявлення про залежність між частинками, які містяться у вузлах кристалічних граток і особливостями будови та властивостями речовин; навести приклади речовин з різними кристалічними гратками.
Обладнання: кристалічні гратки різних речовин.
Хід уроку.
І. Фронтальна бесіда.
- Які види хімічних зв’язків існують?
- Що таке йони?
- Наведіть приклади з різними хімічними зв’язками.
Проблемне питання. Цукор і кухонна сіль схожі за зовнішнім виглядом. Чому ж цукор можна розплавити в умовах нашої кухні, а сіль – ні?
ІІ Засвоєння нових знань, умінь і навичок.
Більшість твердих речовин має кристалічну будову, яка характеризується чітким розташуванням частинок. Якщо з'єднати частинки умовними лініями, то вийде просторовий каркас, який називають кристалічною ґраткою. Точки, в яких розміщені частинки кристалу, називають вузлами ґратки. У вузлах уявної ґратки можуть перебувати атоми, йони або молекули.
Залежно від природи частинок, розташованих у вузлах, і характеру зв'язку між ними, розрізняють чотири типи кристалічних ґраток: йонну, металічну, атомну і молекулярну.
Йонними називають ґраткки, у вузлах яких знаходяться йони.
Їх утворюють речовини з йонним зв'язком. У вузлах таких ґраток розташовуються позитивно і негативно заряджені йони, зв'язані між собою електростатичною взаємодією.
Йонні кристалічні ґратки мають солі, луги, оксиди активних металів. Йони можуть бути простими чи складними. Наприклад, у вузлах кристалічної ґратки натрій хлориду знаходяться прості йони Натрію Na+ і Хлору Cl−, а у вузлах ґратки калій сульфату чергуються прості йони Калію K+ і складні сульфат-йони SO2−4.
Зв'язки між йонами в таких кристалах є міцними. Тому йонні речовини є твердими, тугоплавкими, нелеткими. Такі речовини добре розчиняються у воді.
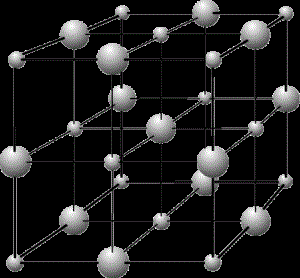
Кристалічна ґратка натрій хлориду

Кристал натрій хлориду
Металічними називають ґратки, які складаються з позитивних йонів, атомів металу і вільних електронів.
Їх утворюють речовини з металічним зв'язком. У вузлах металічної ґратки знаходяться атоми і йони (то атоми, то йони, в які легко перетворюються атоми, віддаючи свої зовнішні електрони в загальне користування).
Такі кристалічні ґратки є характерними для простих речовин металів і сплавів.
Температури плавлення металів можуть бути різними (від –37 °С у ртуті до двох-трьох тисяч градусів). Але всі метали мають характерний металічний блиск, ковкість, пластичність, добре проводять електричний струм і тепло.
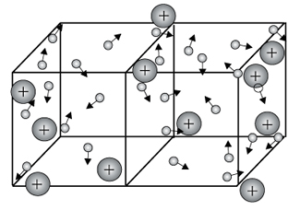
Металічна кристалічна ґратка

Металічні вироби
Атомними називають кристалічні ґратки, у вузлах яких знаходяться окремі атоми, зв'язані ковалентними зв'язками.
Такий тип ґратки має алмаз — одна з алотропних видозмін Карбону. До речовин з атомною кристалічною ґраткою відносяться графіт, кремній (силіцій), бор, германій, а також складні речовини, наприклад, карборунд SiC, кремнезем, кварц, гірський кришталь, пісок, до складу яких входить силіцій(IV) оксид SiO2.
Таким речовинам притаманні висока міцність і твердість. Так, алмаз є найтвердішою природною речовиною. У речовин з атомною кристалічною ґраткою дуже високі температури плавлення і кипіння. Наприклад, температура плавлення кремнезему — 1728 °С, а у графіту вона ще вище — 4000 °С. Атомні кристали практично нерозчинні.
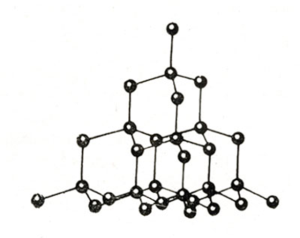
Кристалічна ґратка алмазу

Алмаз
Молекулярними називають ґратки, у вузлах яких знаходяться молекули, пов'язані слабкою міжмолекулярною взаємодією.
Незважаючи на те, що всередині молекул атоми з'єднані дуже міцними ковалентними зв'язками, між самими молекулами діють слабкі сили міжмолекулярної взаємодії. Тому молекулярні кристали мають невелику міцність і твердість, низькі температури плавлення і кипіння. Багато молекулярних речовин при кімнатній температурі є рідинами і газами. Такі речовини леткі. Наприклад, кристалічні йод і твердий карбон(IV) оксид («сухий лід») випаровуються, не переходячи в рідкий стан. Деякі молекулярні речовини мають запах.
Такий тип ґратки мають прості речовини в твердому агрегатному стані: благородні гази з одноатомними молекулами (He,Ne,Ar,Kr,Xe,Rn), а також неметали з двох— і багатоатомними молекулами (H2,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярну кристалічну ґратку мають також речовини з ковалентними полярними зв'язками: вода — лід, твердий амоніак, кислоти, оксиди неметалів. Більшість органічних сполук теж являють собою молекулярні кристали (нафталін, цукор, глюкоза).
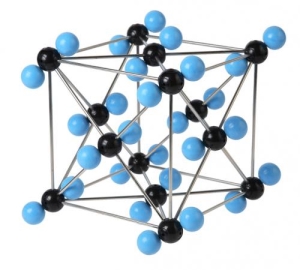
Кристалічна ґратка вуглекислого газу

«Сухий лід»

Кристалики йоду
Якщо відома будова речовини, то можна передбачити її властивості.
Спробуємо визначити, які приблизно температури плавлення у натрій фториду, гідроген фториду і флуору.
У натрій фториду — йонна кристалічна ґратка. Отже, його температура плавлення буде високою. Гідроген фторид і флуор мають молекулярні кристалічні ґратки. Тому їх температури плавлення будуть невисокими. Молекули гідроген фториду є полярними, а флуору — неполярними. Отже, міжмолекулярна взаємодія у гідроген фториду буде сильнішою, і його температура плавлення буде вищою у порівнянні з флуором.
Експериментальні дані підтверджують ці припущення: температури плавлення NaF, HF і F2 складають відповідно 995 °С, –83 °С, –220 °С.
ІІІ. Первинне закріплення матеріалу.
Розподіліть речовини відповідно до типу кристалічної гратки: вода, графіт, пісок, спирт, сода, вуглекислий газ, кухонна сіль, цукор.
|
Молекулярна |
йонна |
атомна |
|
|
|
|
Вторинне закріплення знань.
- Графіт і алмаз складаються з атомів одного й того ж хімічного елемента Карбону. Чому графітові стержні у олівцях без зусиль залишають слід на папері, а алмазне напилення використовують для розрізання найтвердіших матеріалів?
- Камфора – легко кипляча рідина, яку здавна використовували в медицині для приготування розігріваючих компресів. Яка кристалічна гратка цієї речовини?
- Повернемось до проблемного питання. Пояснення з демонстрацією моделей кристалічних граток.
Підсумок уроку.
Домашнє завдання. П.21.Виконати завдання.


про публікацію авторської розробки
Додати розробку
